生体内では電子をやり取りする反応が多数存在します。特に酸化的リン酸化では NADH の酸化で得られたエネルギーをプロトン勾配に変換して、ATP 産生に利用しています。今回は生体内で行われる酸化還元反応とプロトン勾配の形成・NADH 酸化のエネルギー的な関係について解説していきます。
Contents
酸化還元電位とは?
生体反応には電子をやり取りする反応(酸化還元反応)が多数あります。酸化還元反応で電子を受け取った物質は還元体になり、電子を失った物質は酸化体になります。例えば
酸化反応:NADH + H+ → NAD+ + 2H+ + 2e–
還元反応:NAD+ + 2H+ + 2e– → NADH + H+
この反応では NADH + H+ が還元体、NAD+ は酸化体です。さらに酸化体と還元体の組み合わせのことを酸化還元対といいます(図1)。この例ではNAD+/NADH + H+ が酸化還元対です。

例えば
X– + H+ ↔ X + 1/2H2
という反応を利用した電池について考えてみます。各電極で起こる反応以下の通りです。
X– ↔ X + e– :半反応1
H+ + e– ↔ 1/2H2 :半反応2
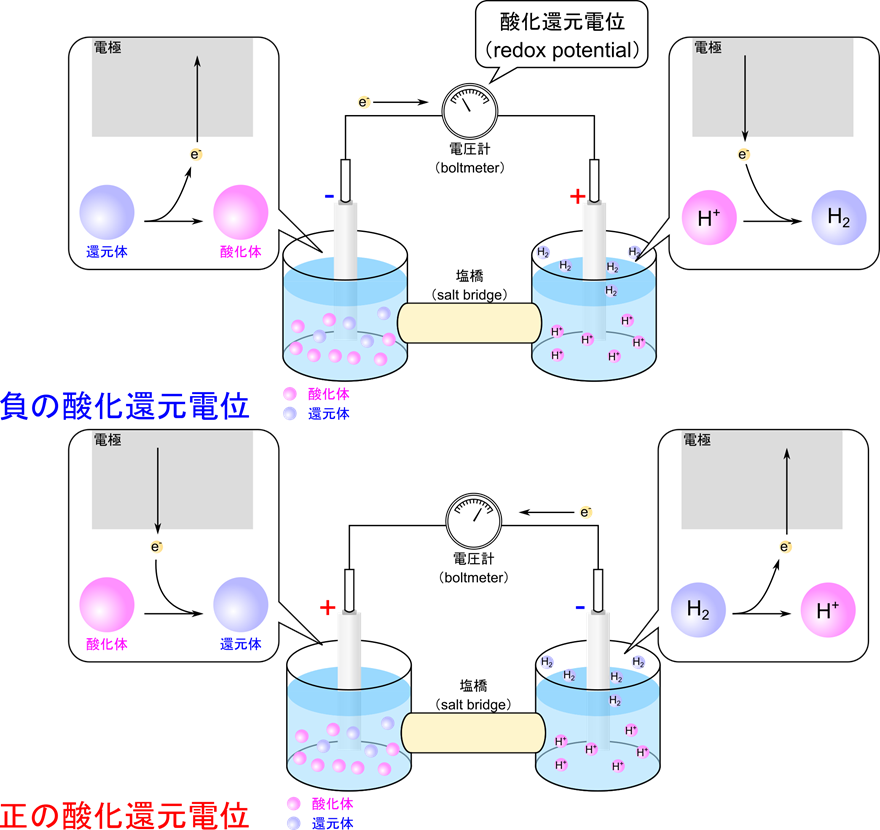
この時、電流がどちら向きに流れるかや各電極間の電位差は酸化還元電位(redox potential)で評価することができます。
(X の酸化還元電位)<0の場合
(X がもつ電子親和性)<(H2 がもつ電子親和性)
この時の反応は以下のようになります
全体の反応:X– + H+ → X + 1/2H2
左の電極:X– → X + e– (酸化)
右の電極:H+ + e– → 1/2H2 (還元)
ですので、電子の流れは
左の電極→右の電極
となります(図2上)。
次に、逆の場合を見てみましょう。
(X の酸化還元電位)>0の場合
(X がもつ電子親和性)>(H2 がもつ電子親和性)
この時の反応は以下のようになります
全体の反応: X + 1/2H2 → X– + H+
左の電極:X + e– → X–
右の電極:1/2H2 → H+ + e–
ですので、電子の流れは
左の電極←右の電極
となります(図2下)。酸化還元電位の定義を確認しておきましょう。
酸化還元電位の定義:
片側の槽に対象物質の還元体(X–) 1M と酸化体(X) 1M の溶液を、もう一方には 1atm の気体 H2 と平衡なプロトン 1M の溶液を入れて発生する電位差を電圧系で測定します。この時、水素を基準点( 0 点)として水素からの電位差を酸化還元電位といいます。
なお、25℃、pH 7 の時の酸化還元電位差を ΔE’0 と表現します。
電池について:
図2の系では二つの槽を用意して電極を設置し、導線で互いの電極を結びます。一方で二つの槽を寒天などで作った塩橋でつなぎます。この塩橋は、電子の移動に伴うイオンの流れを可能にしつつ、槽内の液体が直接混ざらないようにする役割を果たします。
各電極で酸化反応か還元反応が起こります。陰極側(電子を放出する側)では電子が出ていった分プラスに傾きます。一方で陽極側(電子を受け取る側)では電子が流入した分マイナスに傾きます。各電極の電荷の変動を是正するためには、陰極側には陰イオンの、陽極側には陽イオンの流入が起こる必要があります。
電池の構造を壊さないように、イオンの流れを可能にするためには、各電極液が混ざりあわないようにする必要があります。そこで各電極を寒天などで固めた塩溶液でつなぐことで、各電極を隔離しながら、イオンは寒天内を移動することが可能となります。この仕組みは塩橋と呼ばれ、電流がスムーズに流れ続けることを可能にしています。
酸化還元電位のギブスエネルギーへの変換
前の項目で酸化還元反応や酸化還元電位について解説しました。酸化還元電位変化は以下の式でギブスエネルギー変化に変換することができます。
ΔG゜’= – nFΔE’0
ΔG゜’:ギブスエネルギー変化
n :移動した電子の数
F :ファラデー定数 (23.06 kcal/molV)
ΔE’0 :酸化還元電位変化
電位差が発生するということは、電気エネルギーが発生していることを意味します。上記の式は発生している電気エネルギーをギブスエネルギーに変換する式と理解してください。
数式について簡単に解説します。
n は移動する電子の数です。
ファラデー定数は電子 1 mol あたりの電気量です。
移動した総電気量は電子の電荷はマイナスであることも考慮して
(移動した総電気量)= – nF
ΔE’0 は電位差を意味しているので、
(位置エネルギーの差)= – nFΔE’0 = ΔG゜’
位置エネルギーの差は利用できるエネルギーの最大値ですので、これがギブスエネルギーに相当します。
では表1に生化学で出てくるいろいろな物質の酸化体、還元体と酸化還元電位、ギブスエネルギー変化を記載しています。
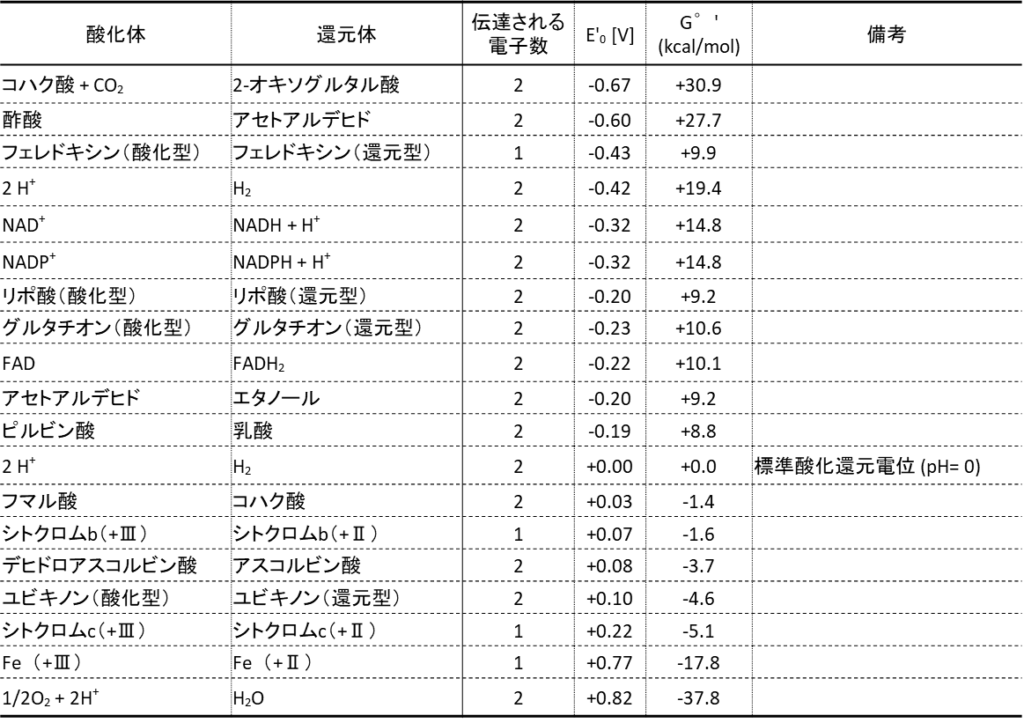
標準状態:pH=7、25 ℃
電子伝達系で行われる NADH の酸化から得られるギブスエネルギー変化は?
電子伝達系では NADH が酸化され、酸素が還元されます。この反応から取り出されたエネルギーはATP の産生に利用されます。この反応は以下の式で表されます。
1/2O2 + NADH + H+ → H2O + NAD+・・・(A)
この反応のギブスエネルギー変化を酸化還元電位から求めてみましょう。
まず、酸化、還元反応それぞれの半反応式を考えます。
半反応式:
1/2O2 + 2H+ + 2e– → H2O E‘0=+0.82 V・・・(B)
NAD+ + H+ + 2e– → NADH E’0=-0.32 V・・・(C)
※酸化還元電位は前の項目の表を参照してください。
この数値は基準値がプロトン/水素であることに注意してください。
NAD+/NADH + H+ と 1/2O2 + 2H+/H2O の間の電位差を計算していきます。
次に (C) をひっくり返して(逆反応を考える場合は符号をひっくり返せば OK です)
NADH → NAD+ + H+ + 2e– E’0=+0.32 V ・・・(D)
(B) に伴うギブスエネルギー変化は
ΔG゜’= -nFE’0 = -2 × 23.06 kcal/mol∙V × (+0.82 V)
=-37.8 kcal/mol
(D) に伴うギブスエネルギー変化は
ΔG゜’= -nFE’0 = -2 × 23.06 kcal/mol∙V × (+0.32 V)
=-14.8 kcal/mol
以下のように (B) と (D) を足すと (A) になるので
1/2O2 + 2H+ + NADH + 2e- → H2O + NAD+ + H+ + 2e–(青字:B、赤字:D)
1/2O2 + NADH + H+ → H2O + NAD+(A と同じになる)
ギブスエネルギー変化も足すと
-37.8 + -14.8 = -52.6 kcal/mol
となります。
したがって NADH が酸化されると -52.6 kcal/mol のエネルギーが得られることになります。ATP の産生に必要なエネルギーが -7.3 kcal/mol であることから考えるとだいぶ大きいエネルギーが得られます。
プロトンをくみ上げるのにもエネルギーが必要
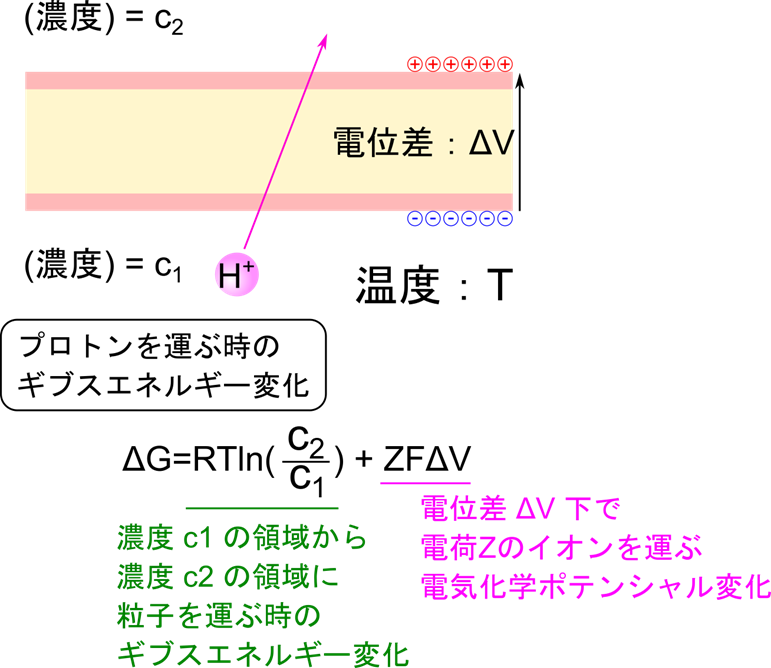
電子伝達系ではミトコンドリアのマトリックス内のプロトンを汲み出すことで電位差を発生させ、ATP の産生・放出の原動力とします。プロトンを汲み出すのにはどれくらいのエネルギーが必要なのか計算してみましょう。なお、今回はミトコンドリアの内膜を跨いだプロトンの汲み出しについて解説します。
膜を通過してイオンを輸送する際のギブスエネルギー変化は以下の式で算出することができます。
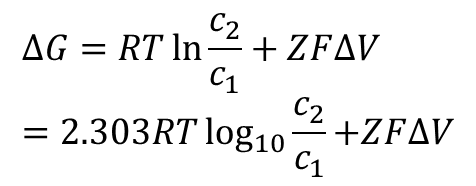
R:気体定数、T:温度、Z:イオンの電荷、F:ファラデー定数
c1:輸送元の濃度、c2:輸送先の濃度、ΔV: 電位差
この式の第一項は濃度 c1 の領域から濃度 c2 の領域にプロトンを運ぶのに必要なエネルギーで、第二項は電位差 ΔV の下で電荷 Z のイオンを運ぶために要するエネルギーに相当しています。
気体定数と温度(ここでは 37℃とします。)はそれぞれ
R=1.99×10-3 kcal/mol・K
T=310 K (37℃)
ここで、c1 や c2 はプロトン濃度ですので -log10 c1 と -log10 c2 はそれぞれ pH を表しますので、pH 差は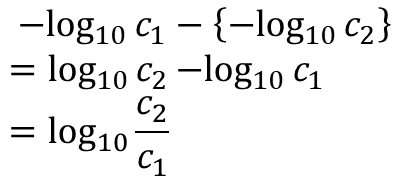
となります。
ミトコンドリアの内膜の外側の pH は内側より 1.4 低いので、![]()
が成立します。さらに、
Z=+1(プロトンの電荷)
F: 23.06 kcal/mol・V
また、ミトコンドリアの内膜の膜電位(ΔV)は 0.14 V で外側が正になっています。
ΔV=0.14 V
以上の数値を使って計算すると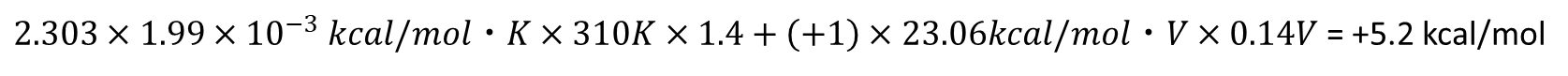 となります。
となります。
この結果はプロトン運搬には 5.2 kcal/mol のギブスエネルギーの供給が必要であることを意味します。
このようにしてプロトンを汲み出してプロトン勾配を発生させることができます。プロトンは正に荷電しているのでプロトン濃度に差がある状態は電位差を発生させます。この電位差が ATP 産生に必要なエネルギーを供給します。
今回は酸化還元電位と膜電位について解説しました。酸化的リン酸化では、補酵素である NADH や FADH2 を酸化して得られるエネルギーを利用してプロトン勾配を形成し、ATP を産生します。今回の内容ではこの流れを数式を使って具体的に解説しています。今後は今回の内容を基礎にして酸化的リン酸化のメカニズムについて解説しいきますので、ぜひ他の記事も合わせて参照してください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 139-150
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 485-519
関連記事
- プロトン勾配と酸化還元反応をエネルギー的な観点から解説:生体内のエネルギー流れ(←イマココ)
- 細胞のエネルギー工場:ミトコンドリアとATP生成メカニズム
- 電子伝達系を徹底解説:プロトン汲み出しのメカニズムとは?
- 化学浸透圧説を徹底解説:プロトン勾配とATP合成の重要なつながり
- NADHの電子はどう運ばれる?ミトコンドリア膜を越えた物質輸送を解説