タンパク質にとって形はとても重要な意味を持ちます。よく酵素(触媒作用を持つタンパク質)と基質(酵素が作用する対象)の関係は鍵と鍵穴に例えられます。これはお互いの形がうまく合うこと、その時に作用する個所に酵素の活性部位が接することができることが、酵素が機能する重要な要素であることを表現しています。今回はタンパク質がいかにして適切な形をとることができるのかを解説します。
Contents
タンパク質の構造
タンパク質の構造は階層構造で分類されています。これらの構造には以下の四種類があります。
- 一次構造(primary structure)
- 二次構造(secondary structure)
- 三次構造(tertiary structure)
- 四次構造(quaternary structure)
それぞれの構造について詳しく見ていきましょう。
一次構造
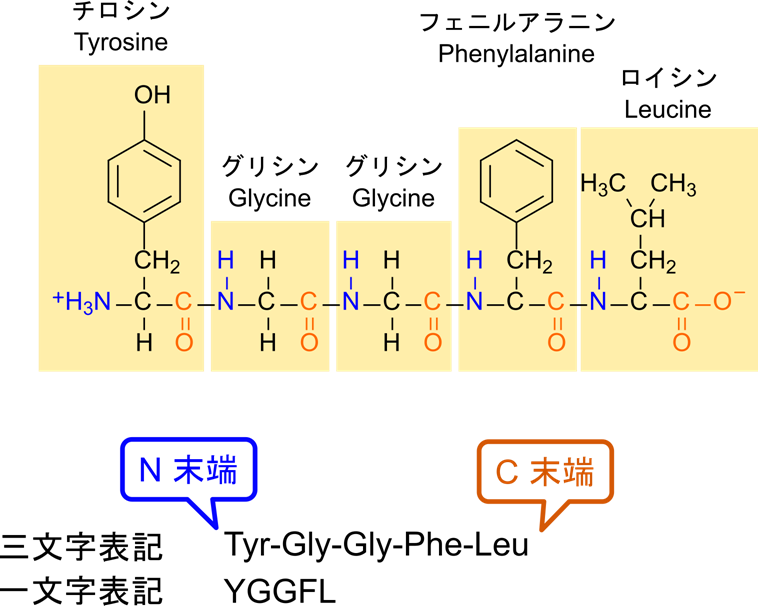
一次構造はアミノ酸残基の並びのことです。アミノ酸残基の並びを記載する場合はN 末端側から記載します。図1の例では N 末端側からチロシン、グリシン、グリシン、フェニルアラニン、ロイシンの順に並んでいます。このため三文字表記なら Tyr-Gly-Gly-Phe-Leu となり、一時表記の場合は単に YGGFL と記載します。
二次構造
ペプチド結合は二重結合性のため平面を構成します(詳細はこちらの記事で)。また、この平面を挟む二つの結合は回転可能なので、ペプチド結合の平面と回転可能な単結合を使って折りたたみ構造(フォールディング)をとります。さらに、フォールディングは水素結合などの非共有結合を利用して安定化されます。代表的な構造には以下のようなものがあります。
- α ヘリックス:らせん上の構造。
- β ストランド:ペプチド結合が波状に並んだ比較的まっすぐな構造
- β シート:β ストランドが並んでシート状の構造をとる構造
- ランダムコイル:決まった構造は持たない構造
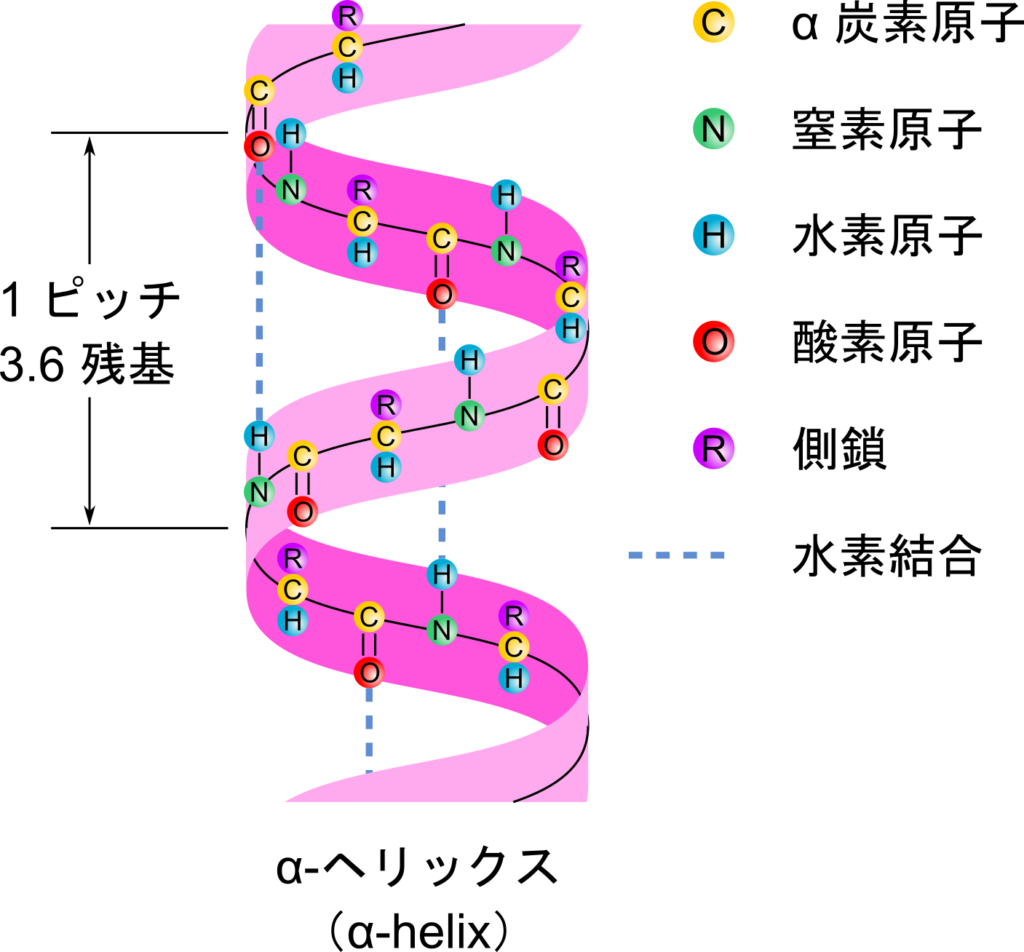
α ヘリックス(α helix)構造
α ヘリックス構造はらせん状の構造です。α ヘリックスはほとんどの場合が右巻きになります(右手の親指を C 末端側に向けた場合に他の指先が向く方向がらせんの方向になっている場合に右巻きとなります)。左巻きもあることはありますが、極めてまれです。これは右巻きの方が立体障害が少ないためです。らせんは 3.6 残基で一周し、長さは 5.4 Å です。カルボニル基(C=O)は 4 残基先のアミド基(-NH-)と水素結合を形成し、らせん構造を支えています。
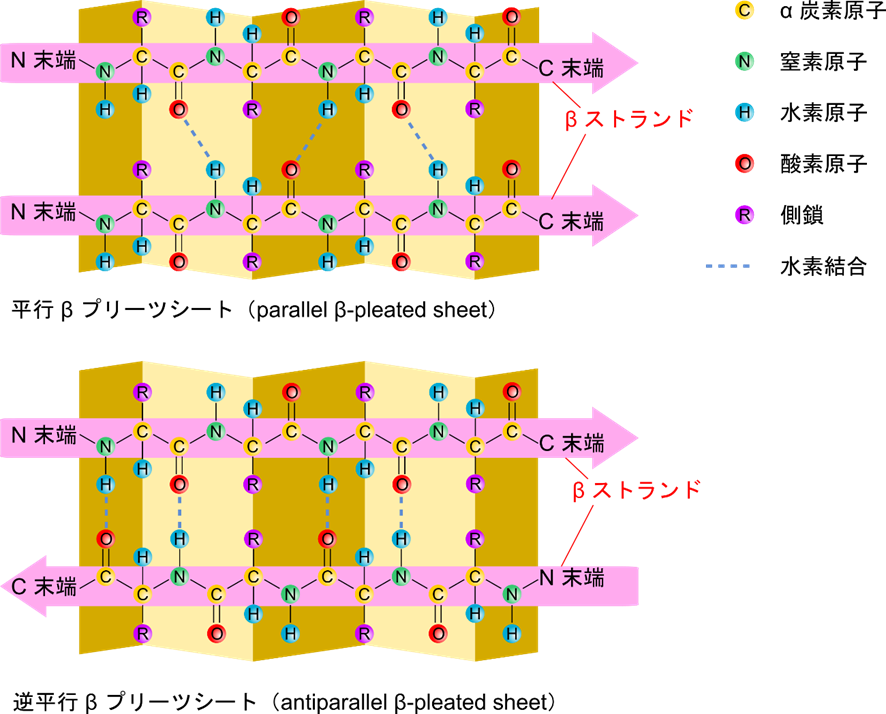
β ストランド構造(β strand)・βシート(β sheet)構造
β ストランド構造はペプチド結合の平面が波状で直線状に配列した構造をしています。この構造はよく平行に並んで β シート構造をとります。β ストランドが同じ方向に向いて並ぶと平行 β プリーツシート(parallel β pleated sheet)と呼ばれます。β ストランドが逆方向に向いて並ぶと逆平行 β プリーツシート(antiparallel β pleated sheet)と呼ばれます。なお、β ストランドは矢印で表されます。この時矢印の向く方向が C 末端になります。
タンパク質の中の二次構造を確認してみましょう
二次構造がどのように配置しているのかを図4に示しています。FABP では β ストランドが逆方向に並んで β シート(逆平行 β プリーツシート)を構成しています。また、α ヘリックス構造も二つ見られます。CCL14 でも β シートや α ヘリックス構造が見られます。このようにタンパク質は二次構造の組み合わせによって立体構造を構成しています。

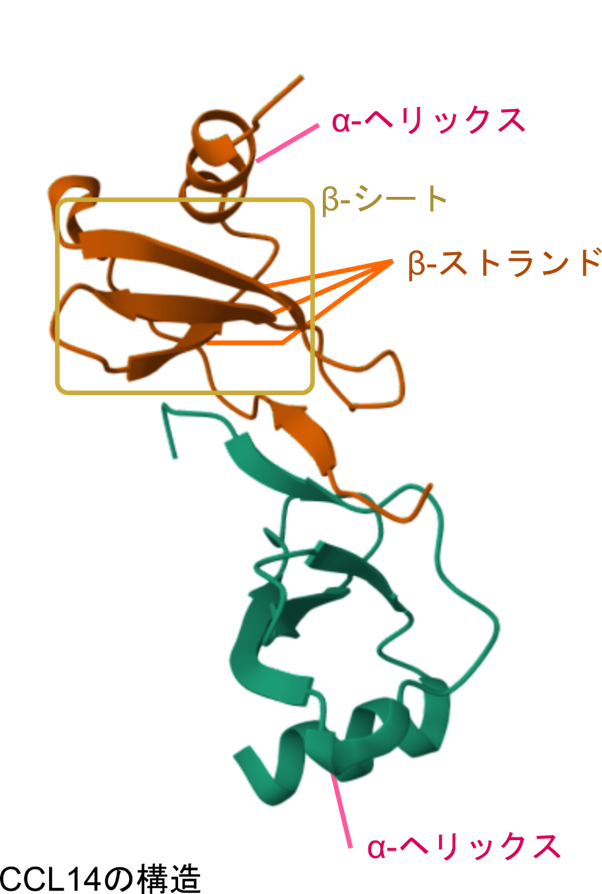
フォールディングの角度は二つのパラメータで表す
フォールディングによる各平面同士の位置関係は二つのねじれ角で表すことが可能です(図5)。
- Φ:α 炭素 – アミノ基方向から見たときのカルボニル基同士がなす角度
- ψ:C-Cα 方向から見た場合に二つのアミノ基同士がなす角度
ところで原子にはそれぞれ大きさがあるため、どのような角度でもとれるわけではありません。原子同士の立体障害が起こるため、Φ と ψ がとりうる値には制限があります。Φ と ψ をプロットしたものはラマチャンドランプロット(Ramachandran plot)と呼ばれており、Φ と ψ が取り得る関係を表すために利用されています。
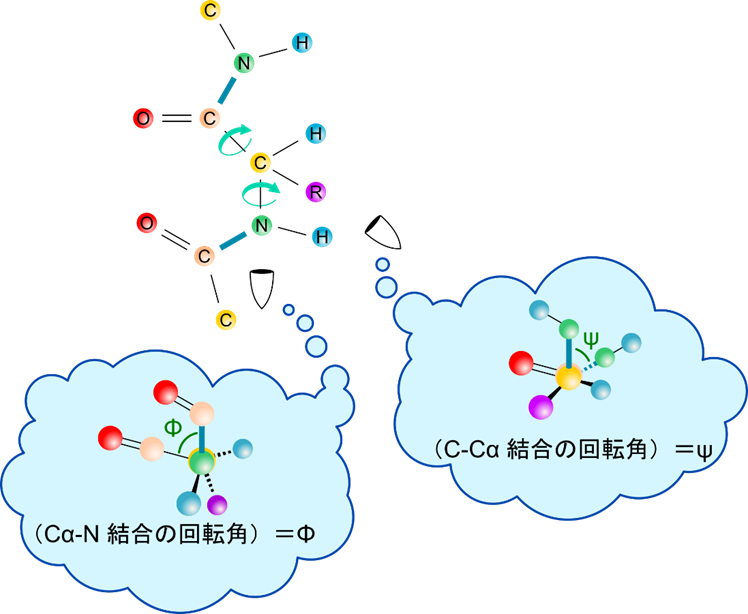
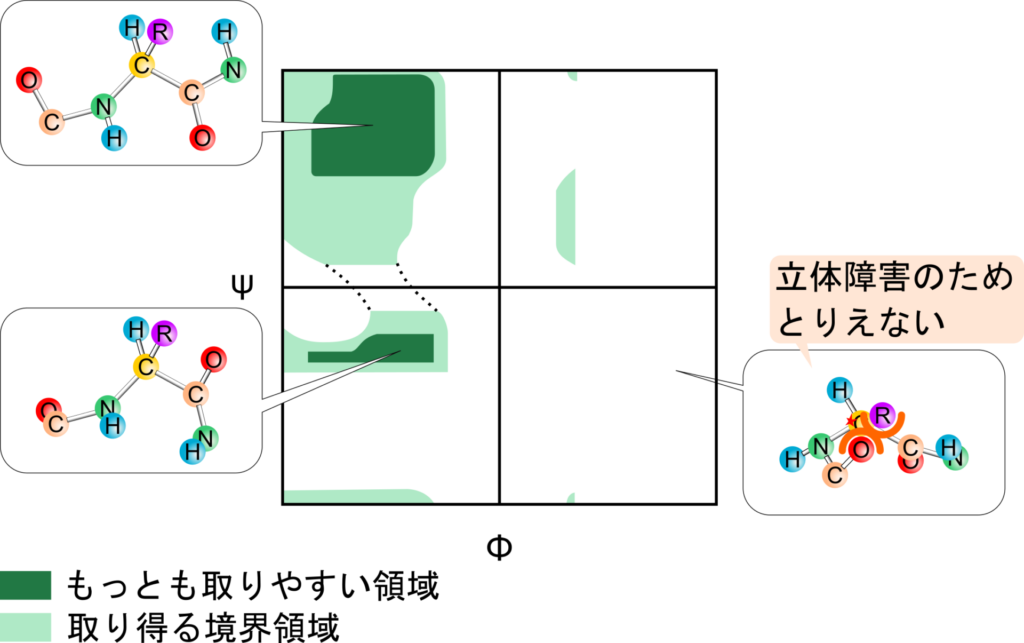
図6にラマチャンドランプロットの例を示します。Φ と ψ の取り得る値は緑で表した領域だけです。図6を見てわかるように緑の領域、特に濃い緑で表した領域は立体障害が起こらないため、もっとも取りやすい領域です。一方で、白抜きの領域は立体障害が起きるため、とることができない領域です。ラマチャンドランプロットを見ると Φ と ψ の組み合わせは意外と少ないことがわかりますね。
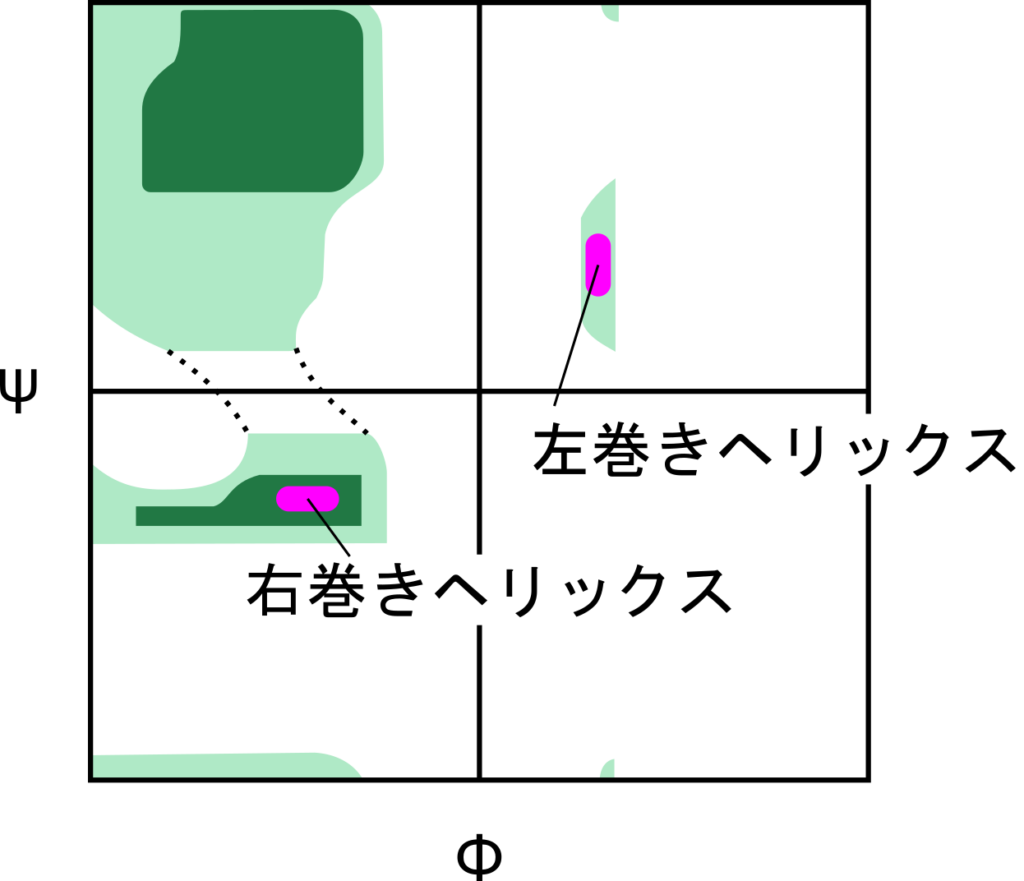
ラマチャンドランプロットは想定する構造が許容されるのかを確認するために利用されます。例えば、図7には α ヘリックス構造(らせん構造)のラマチャンドランプロットを表しています。赤の領域が α ヘリックスをとるときの領域を表しています。右巻きのらせん構造も左巻きのらせん構造も緑の領域内に収まっており、取り得る構造であることがわかります。通常、右巻きのらせん構造の方が安定しているため、ほとんどは右巻きのらせん構造をとり、左巻きのらせん構造は稀です。ラマチャンドランプロット上でも右巻きの領域は濃い緑の上にあり、安定であることがわかります。
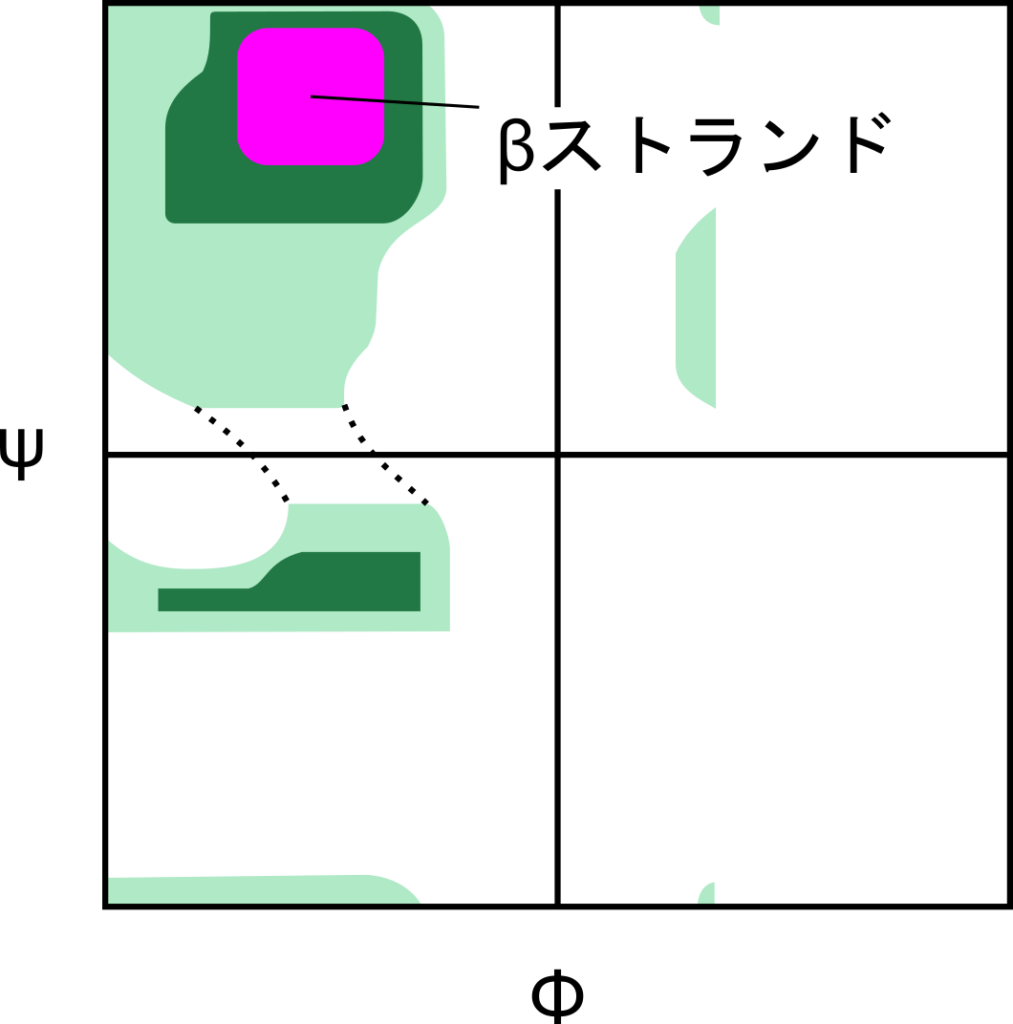
β ストランド(まっすぐな構造)をとるときの領域もラマチャンドランプロット上で確認すると、濃い緑の領域上にあることが確認でき、安定した構造であることが確認できます。
このように、ラマチャンドランプロットを利用すると、どういう構造を取り得るのかを推定することができます。
三次構造
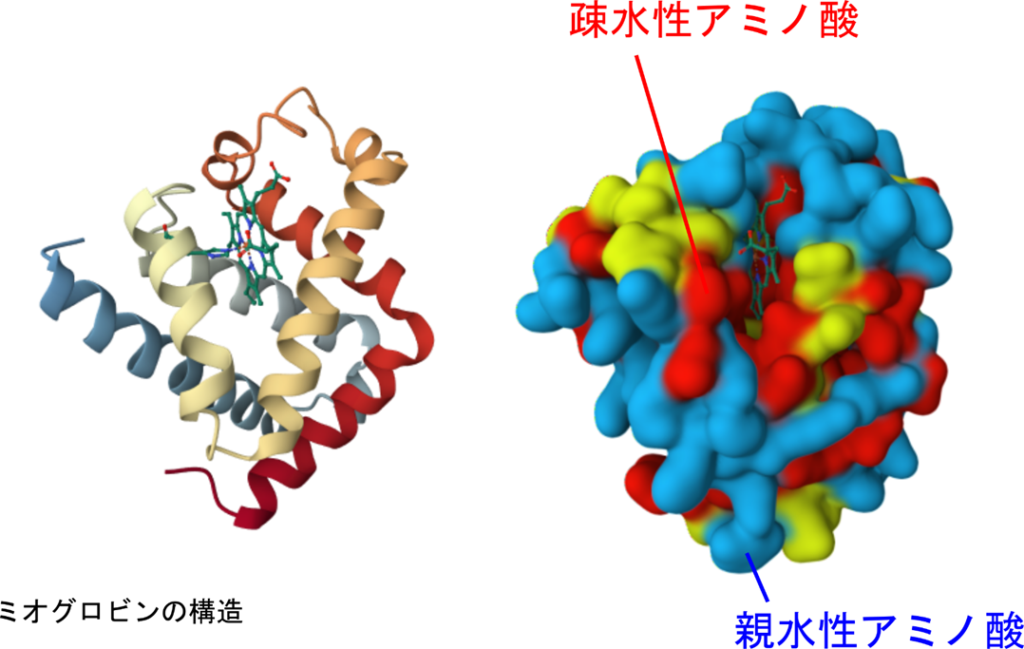
ミオグロビンはいくつかの α ヘリックスを持っていますが、この α ヘリックスはより大きな構造の部分構造をなしています(図9左側)。こミオグロブリンはフォールディングをとる際に内側により疎水性のアミノ酸を外側に親水性のアミノ酸を配置しています(図9右側)。このような配置は水中のような環境で安定して存在するために有利な構造です。また、ミオグロビンは酸素を筋肉中に保持する役割を担っていますが、この役割で中心的な役割を持っているのはヘム鉄です。ヘム鉄はミオグロビンの表面にあるポケット内に結合しており、酸素がアクセスできるようになっています。このように、機能を果たすために適切な形をとるために、タンパク質は適切なフォールディングをとりますが、こうして形成される立体構造のことを三次構造といいます。三次構造は二次構造の組み合わせによって成り立っています。
四次構造
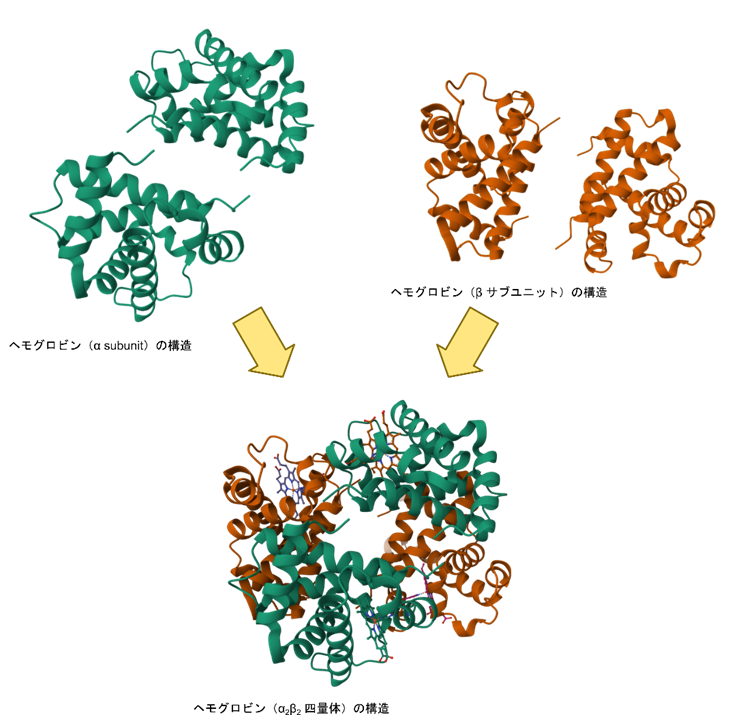
ヘモグロビンは α サブユニット2つと β サブユニット2つが会合して構成されています。タンパク質を構成する単位(個々のポリペプチド)のことをサブユニット(subunit)といいます。このようにいくつかのポリペプチドから成る構造のことを四次構造といいます。ポリペプチド鎖一つから構成されるタンパク質を単量体(monomer)、二つの場合は二量体(dimer)、三つの場合は三量体(trimer)、ヘモグロビンのように四つある場合には四量体(tetramer)という具合に分類します。
タンパク質を構成するポリペプチド鎖はそれぞれに役割を担っており、互いに会合することで機能を発揮できる構造を持つことができるようになります。また、いくつかの種類のポリペプチドがいくつかの組み合わせをとることで異なる機能を発揮する場合があります。たとえば、味覚レセプターとして知られている、Taste Receptor 1 type 1(T1R1)、Taste Receptor 1 type 2(T1R2)、Taste Receptor 1 type 3(T1R3)は機能する場合には二量体を形成しており、T1R2/T1R3 の組み合わせでは甘味を、T1R1/T1R3 の組み合わせでは旨味を認識します。 このようにサブユニットの組み合わせ使うことで機能にバリエーションを与えることが可能です。
タンパク質の修飾
翻訳後修飾(post translational modification; PTM)
以前の記事でタンパク質には糖タンパク質やリポタンパク質のように糖鎖や脂質が結合しているものがあるということを紹介しました(詳細はこちら)。タンパク質は合成されるとゴルジ体で糖鎖や脂質を付加されます。このような糖鎖や脂質付加のことをタンパク質修飾(protein modification)といいます。この過程は翻訳後修飾(post translational modification)と呼ばれています。
翻訳後修飾には様々なものが知られていますが、ここでは代表的なものを紹介します。
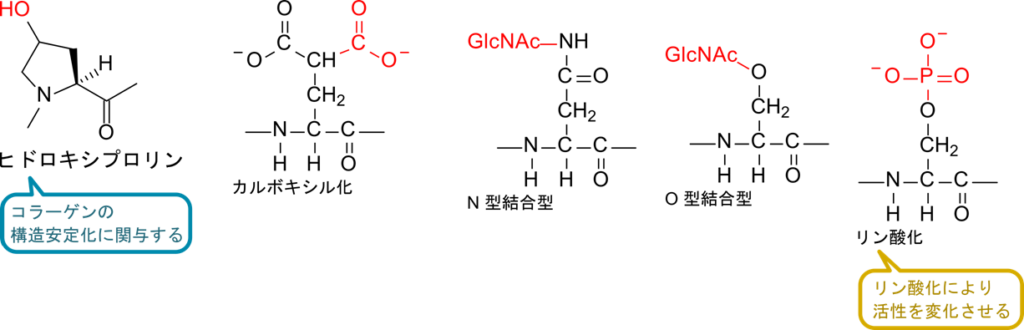
- ヒドロキシプロリン
- コラーゲンに見られる構造で、プロリンに水酸基が付加されています。水酸基が付加されることにより、水素結合を形成することができるようになり、コラーゲンの構造を安定化させることに寄与しています。
- カルボキシル化
- グルタミン酸残基が受けることがある修飾で、骨形成タンパク質などいくつかのタンパク質で見られます。
- N 結合型糖鎖
- アスパラギンの側鎖アミド窒素に糖鎖が結合した糖鎖修飾です(窒素に結合するので N 型です)。アスパラギンに結合する糖は N-アセチルグルコサミンで、N-アセチルグルコサミン2残基とマンノース3残基から成るコア構造を持っています。このコア構造にさらに様々な糖が結合していくことで多様な構造が形成されます。
- O 結合型糖鎖
- N 結合型糖鎖がアスパラギンに結合していた一方で、O 型ではセリンやトレオニンの水酸基に結合する糖鎖です(酸素に結合するので O 型と呼ばれます)。この糖鎖では N-アセチルグルコサミン、N-アセチルガラクトサミン、フコース、マンノースなど、様々なものが結合します。
- リン酸化
- ある種のタンパク質ではセリンやトレオニン、チロシンなどのアミノ酸残基がリン酸化を受けることがあります。リン酸化を受けるアミノ酸残基が水酸基を持ったものに限定されているのは、 水酸基がATP から供給されるリン酸基のリンを求核的に攻撃できるためです。このようなリン酸化は細胞周期や増殖、シグナル伝達などの場面で重要な役割を担っています。リン酸化は可逆的でリン酸基が付いたり離れたりすることで、タンパク質が機能する際のスイッチの役割を担っています。
タンパク質の前駆体は切断を受けることで活性化する
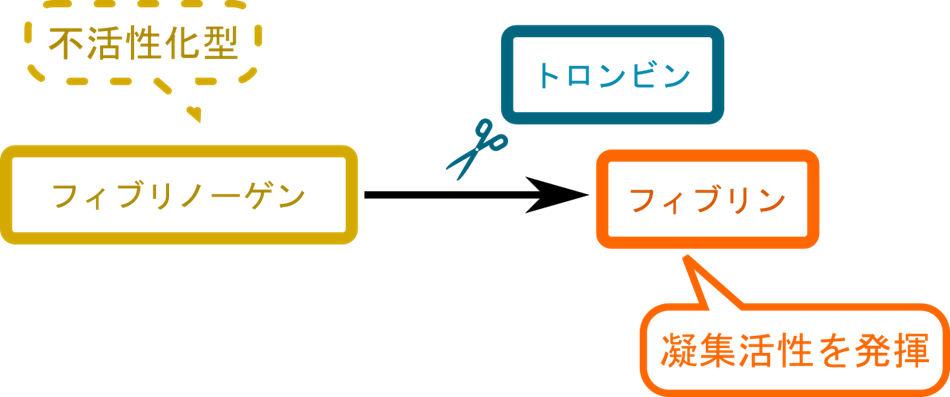
フィブリノーゲンは血液凝固にかかわるタンパク質の前駆体ですが、それ自体では活性を示しません。ここにトロンビンが作用すると適切な位置で切断を受けて活性化型のフィブリンに変換されます。フィブリンは凝集活性を発揮して血液を凝固させます。当然ですが不適切なタイミングでこのような反応が起こってしまうと血栓ができてしまいます。ですので、トロンビンによって制御することで不適切な活性が起こらないようにコントロールしています。このような活性の調節はトリプシノーゲンが切断を受けると消化酵素のトリプシンになるなど様々なタンパク質で見られます。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 36-66
- John McMurry 著、伊東椒 児玉三明訳 (2018). マクマリー有機化学 第4版. 東京化学同人. pp. 472-501
- Paula Y. Bruice 著、大船泰史、香月勗、西郷和彦、富岡清訳 (2016). ブルース 有機化学 概説 第3版. 化学同人. pp. 639-672
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 26-95