アミノ酸は重合することでポリペプチドを形成します。ポリペプチドは長さによってペプチドやタンパク質と呼ばれ、生体内で実に様々な機能を担っています。近年になって遺伝子工学の発展によってタンパク質の研究と応用が進み、現代生命科学のメインツールにまでなりました。今回はこのポリペプチドの基礎知見を紹介します。
Contents
ペプチドの定義と構造
アミノ酸の脱水縮合とポリペプチド
アミノ酸はアミノ基とカルボキシル基が脱水縮合することで重合することができます。この結果、多数のアミノ酸が結合した高分子を形成することができます。このような高分子化合物のことをポリペプチドと呼びます。その中でも、比較的短いものをペプチドと呼びます。生体内では、より大きなタンパク質の分解産物として産生される場合が多く、様々な生理活性を有していることもあります。
図1に示すように、ペプチドやタンパク質の末端は片方がアミノ基、もう一方がカルボキシル基になっています。このことからアミノ基側の末端のことを「アミノ基末端(N 末端;N-terminus)」といい(アミノ基に含まれる窒素原子に由来します)、カルボキシル基側の末端のことを「カルボキシル基末端(C 末端;C-terminus)」といいます(カルボニル基の炭素原子に由来します)。ちなみにポリペプチドの一部を構成するアミノ酸単位については厳密にはアミノ酸ではないので「アミノ酸残基」と呼びますので、注意してください。
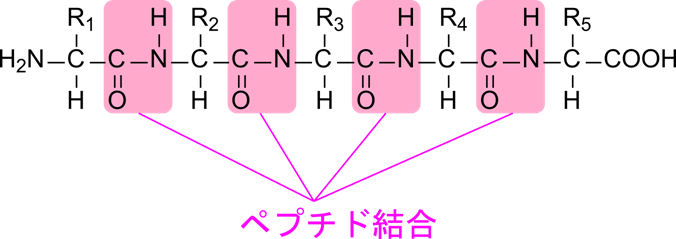
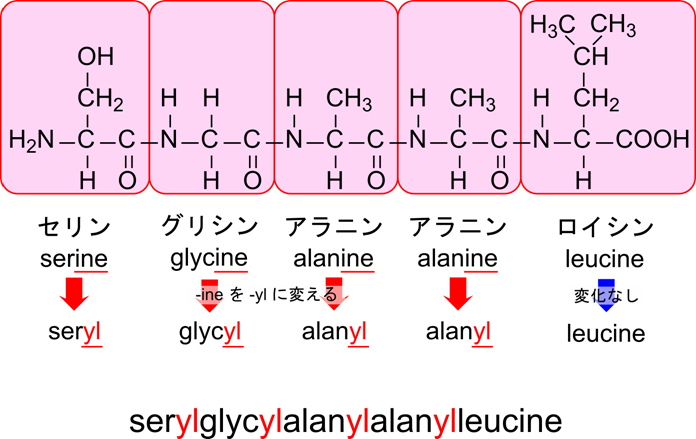
ペプチドの命名法を図2に示しています。ペプチドを命名する場合には N 末端側からアミノ酸名を並べます。この順はタンパク質が翻訳される順番に従っています。次に並べたアミノ酸名の -イン(-ine)を -イル(-yl)に変えて記載します。ただし、最後(C 末端)のアミノ酸残基だけはそのままにします。図2に示す例を見てみましょう。
- N 末端側からアミノ酸名を並べます
- セリン-グリシン-アラニン-アラニン-ロイシン; serine-glycine-alanine-alanine-leucine
- アミノ酸名の末端を -イル(-yl)に変えます。ただし、C 末端のアミノ酸残基だけはそのままにします
- セリル-グリシル-アラニル-アラニル-ロイシン; seryl-glycyl-alanyl-alanyl-leucine
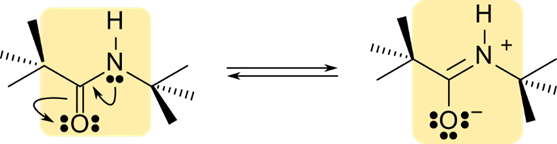
ペプチド結合の二重結合性
ペプチド結合は図3に示すように共鳴構造をとります(C=O の π 電子が酸素側に、窒素の非共有電子対が C-N 結合に遷移します)。その結果、C-N 間の結合が二重結合になります。 この特性のため以下のような特性が生まれます。
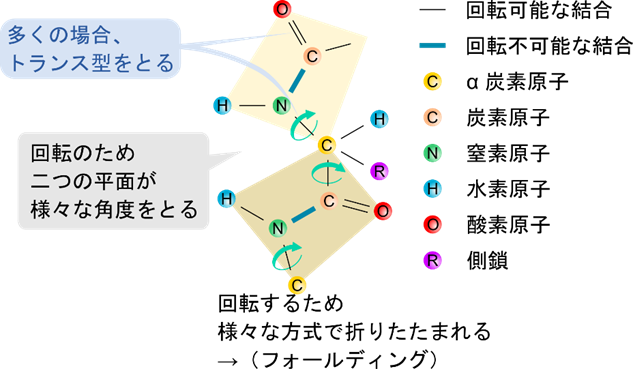
- ペプチド結合を含む平面が存在
- 一つ目アミノ酸の α 炭素、カルボニル基(C=O)、アミノ基(N-H)、二つ目のアミノ酸残基の α 炭素が同一平面上にあります
- ペプチド結合は回転不可能
- 一見単結合のため回転可能なように見えますが、実際は二重結合性を持つため回転不可能です
- ペプチド結合はトランス型
- 一つ目のアミノ酸と二番目のアミノ酸がトランス型の配置をとります
α 炭素とアミノ基の結合や α 炭素とカルボニル基の結合には二重結合性がないため回転が可能です。この回転のため、ペプチド結合を含む平面同士が様々な角度をとることが可能です。また、回転の方向によって様々な形で折りたたまれます。この折りたたまれることをフォールディング(folding)といいます。
タンパク質の分類と特徴
タンパク質はポリペプチドの内サイズの大きなものを言います。厳密に決まっているわけではありませんが、一般に以下のように呼び分けます。
- ~ 50 kDa(~ 50 アミノ酸残基):ペプチド
- 50 kDa ~ 220 kDa(50 ~ 2,000 アミノ酸残基):タンパク質
アミノ酸残基は一残基当たりだいたい平均 110 Da です。タンパク質の議論をする場合は一般に分子量を使う場合が多いです。一方で、核酸のサイズを議論する場合には塩基対数で議論する場合が一般的です。この齟齬のため遺伝子配列から推定されるタンパク質のサイズはアミノ酸残基数に基づくものとなる一方で、タンパク質レベルで議論する場合には分子量を利用することになります。もちろん、アミノ酸配列を使って適切なプログラムを利用すると正確に分子量を推定することはできますが、研究現場では、アミノ酸残基数からタンパク質の分子量を簡単に推測したい場合もあります。この場合はアミノ酸残基数に 110 Da をかけるとおおよその分子量が求まります。意外と便利なので覚えておいて損はないと思います。
タンパク質の分類
タンパク質は注目する特性によって何通りかの分類があります。代表的なものについてみていきましょう。
化学組成による分類
化学組成による分類をすると以下のようになります。タンパク質は翻訳されたのちに翻訳語修飾により糖鎖や脂質などの修飾を受ける場合があります。これらの修飾は機能上、重要な役割を有する場合も多く、この修飾に基づいた分類もよく利用されます。
- 単純タンパク質(simple protein) :アミノ酸のみから構成されるタンパク質
- 複合タンパク質(conjugated protein):アミノ酸以外の成分を含むもの
- 核タンパク質(nucleoprotein) :核酸を含むもの(ex. ウイルスなど)
- 糖タンパク質(glycoprotein) :糖鎖を含むもの(ex. オボアルブミンなど)
- リポタンパク質(lipoprotein) :脂質を含むもの(ex. 血漿タンパク質など)
- 色素タンパク質(chromoprotein) :色素を含むもの(ex. ヘモグロビンなど)
構造による分類
タンパク質はどこで機能するのか、どういった機能を発揮するのかによって、タンパク質の構造(カタチ)が重要になります。このため、どういった構造をとるかによっても分類されています。
- 球状タンパク質(globular protein)
- ex. 酵素、抗体、ホルモン など
- 繊維状タンパク質(fibrous protein)
- ex. コラーゲンなど
性状による分類
単純タンパク質は性状や生体内の存在場所によって以下のように分類されます。このような分類は生理的機能と結びついている場合が多く、よく使用される分類です。
- アルブミン(albumin)
- 純水に可溶
- 高濃度の塩溶液で沈殿を形成する
- 分子量は小さめ
- 熱、酸、エタノールで変性して凝固する
- 存在する場所に応じて以下のように呼ばれる
- オボアルブミン(Ovalbumin; OVA):卵白中
- 血清アルブミン(serum albumin):血清中
- 筋アルブミン(myoalbumin):筋肉中
- グロブリン(globulin)
- 純水に不溶
- 中性の塩溶液に可溶
- 熱で凝固する
- 例:血清グロブリン、オボグロブリン、ラクトグロブリン、抗体(免疫グロブリン)
- プロラミン(prolamin)
- 水、中性塩溶液に不溶
- 60 ~ 90 % のエタノールに可溶
- 穀物中に存在
- 例:グリアジン、ゼイン
- グルテリン(glutelin)
- 水、中性塩溶液、エタノールに不溶
- 希酸及び希アルカリに可溶。
- 穀物中に存在
- 例:グルテニン(小麦種子中)
- アルブミノイド(albuminoid;硬タンパク質(scleroprotein)ともいう)
- 水、塩溶液、有機溶剤、希酸、希アルカリに不溶
- ほとんど酵素作用を受けない
- 濃い酸やアルカリに構造変化を伴って溶ける
- 例:コラーゲン、ケラチン
タンパク質の構造を支える結合様式
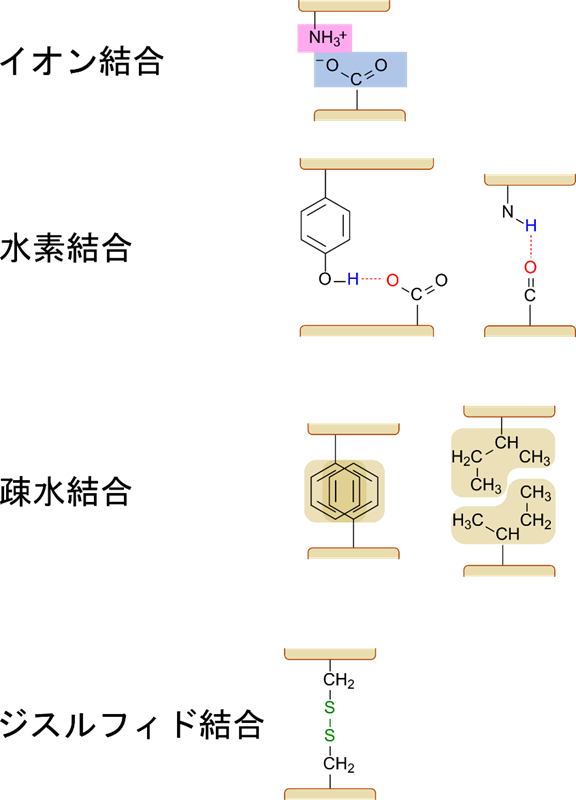
別の記事で詳細を紹介する予定ですが、タンパク質は折りたたまれて様々な形をとります。他にも複数のタンパク質が互いに結合して複合体を形成することもあります。これらの構造を支える(あるいは橋渡しをする)結合にはどんなものがあるでしょうか?以下に主なものを示しています。
イオン結合(ionic bond)
アミノ酸にはアミノ基とカルキシル基があります。これらの置換基はプロトンを受け取ったり放出したりすることによってイオン化します。当然ですがアミノ酸で構成されているタンパク質にもこれらの置換基は存在します。特に、リシンやアルギニンなどの側鎖にアミノ基を持つアミノ酸残基やグルタミン酸やアスパラギン酸のような側鎖にカルキシル基を持つアミノ酸残基はイオン結合を形成する有力な候補になります。
アミノ基はプロトンを受け取るとカチオン(陽イオン)性の置換基になります。一方でカルボキシル基はプロトンを放出してアニオン(陰イオン)性の置換基になります。その結果、正の電荷と負の電荷をもつことになりますので、静電気力によって結合が形成されます。これがイオン結合です。
水素結合(hydrogen bond)
酸素や窒素など電気陰性度の高い原子と水素が結合していると、水素原子は正に荷電します。このため、(物理的に)近傍にフッ素や酸素、窒素、硫黄など非共有電子対を持つ原子があると、非共有結合性の結合を形成します。タンパク質など有機化学分野では特に重要なのは酸素、窒素、硫黄です。
ポリペプチドにはセリンやトレオニン、チロシンのように水酸基を持つものやアルギニンやリシンのようにアミノ基を持つものがあり、これらのアミノ酸残基が他のアミノ酸残基の酸素や窒素との間に水素結合を形成します。また、ペプチド結合のアミノ基の水素とカルボニル基の酸素間にも水素結合が形成されます。
疎水結合(hydrophobic bond)
疎水性の物質が水溶液中にあると、疎水性の物質同士が集まって凝集します。この現象は疎水性の物質は水分子からはじかれてしまうので、水分子との接触を避けようとする結果、疎水性の物質が互いに集まるため起こります(ドレッシングを放っておくと水と油に分離する現象に似ています)。疎水性の物質が互いに集まると、凝集してしまいどれほど激しく攪拌しても分散しなくなります。このように疎水性の物質同士が集まって固まってしまうのは互いに疎水結合を形成しているためです。生物の体は基本的に水で構成されていますので、疎水性の物質は疎水結合を形成します。
アミノ酸ではアラニンやフェニルアラニン、ロイシンのような疎水性アミノ酸残基は疎水結合を形成します。
ジスルフィド結合(disulfide bond)
二つのチオール基(-SH 基)があった場合、還元状態では -SH 基の形をとりますが、酸化されるとジスルフィド結合(-S-S-)を形成します。
ジスルフィド結合の形成:R-SH + R’-SH → R-S-S-R’ + 2H+ + 2e–
この結合のポイントとなるのはシステインです。システインは側鎖にチオール基(-SH基)を持っています。このチオール基が酸化されることでジスルフィド結合を形成します。
ここで紹介した結合様式はタンパク質が複合体を形成するときや高次構造をとる場合にとても重要になりますので、しっかり理解してください。
今回はペプチドとタンパク質について基本的な内容をまとめてみました。ペプチドとタンパク質は基本的な構造が類似しています。特にタンパク質は生命科学領域でも最もよく研究されている領域でもあり、応用も進んでいる領域です。この記事で紹介した基礎知見はタンパク質に関連する研究でもよく出てくるものがたくさん含まれていますので、ぜひこの記事で知識を確認してみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 36-66
- John McMurry 著、伊東椒 児玉三明訳 (2018). マクマリー有機化学 第4版. 東京化学同人. pp. 472-501
- Paula Y. Bruice 著、大船泰史、香月勗、西郷和彦、富岡清訳 (2016). ブルース 有機化学 概説 第3版. 化学同人. pp. 639-672
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 26-95