1953 年に DNA の二重らせん構造が発見されて以来、核酸ほど注目を浴びた分子はないでしょう。核酸が持つ遺伝情報の解析と応用は近代生命科学の発展に寄与してきました。核酸はヌクレオチドにより構成されますが、そのヌクレオチドはいかにして合成されているのでしょうか?この記事ではヌクレオチドの合成経路について解説します。
Contents
ヌクレオチドの生合成経路;de novo 経路とサルベージ経路
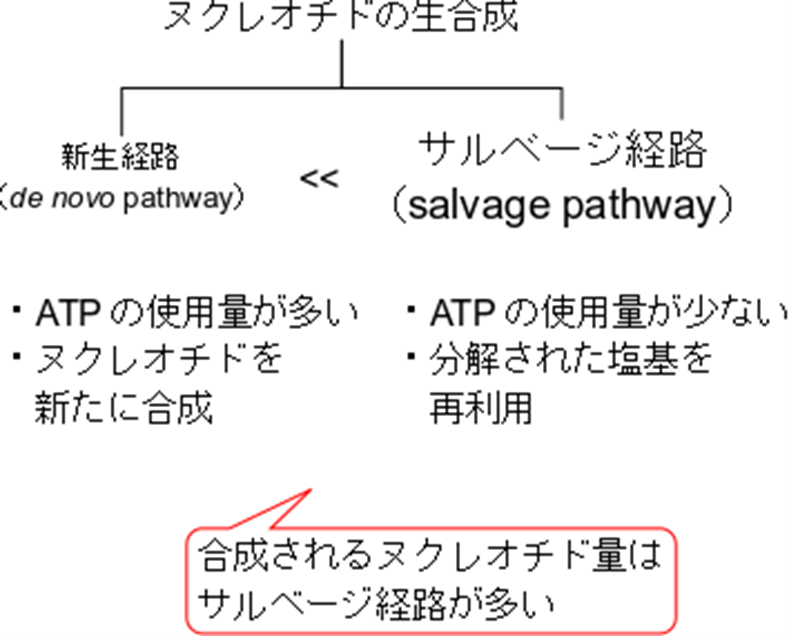
ヌクレオチドの生合成には、新たに合成される「de novo」合成経路と、ヌクレオチドの分解産物を再利用する「サルベージ経路(salvage pathway)」の2つの方法があります。de novo経路では、ATPを多く消費するため、エネルギーコストが高くなります。このため、体内ではエネルギー効率を高めるために、主にサルベージ経路を用いてヌクレオチドが合成されています。サルベージ経路は、ATPの消費を抑えつつ、効率的にヌクレオチドを供給するために重要な役割を果たしています。
ヌクレオチドの生合成には、新たに合成される「de novo」合成経路と、ヌクレオチドの分解産物を再利用する「サルベージ経路(salvage pathway)」の2つの経路があります。de novo 経路では、ATPを多く消費するため、エネルギーコストが高くなります。このため、体内ではエネルギー効率を高めるために、主にサルベージ経路を用いてヌクレオチドが合成されています。
ヌクレオチドの de novo 経路
ヌクレオチドの新規合成経路ではピリミジンヌクレオチドの合成経路とプリンヌクレオチドの合成経路が存在しています。まずはそれぞれの塩基の元素がどこから提供されるのかについてみていきましょう。
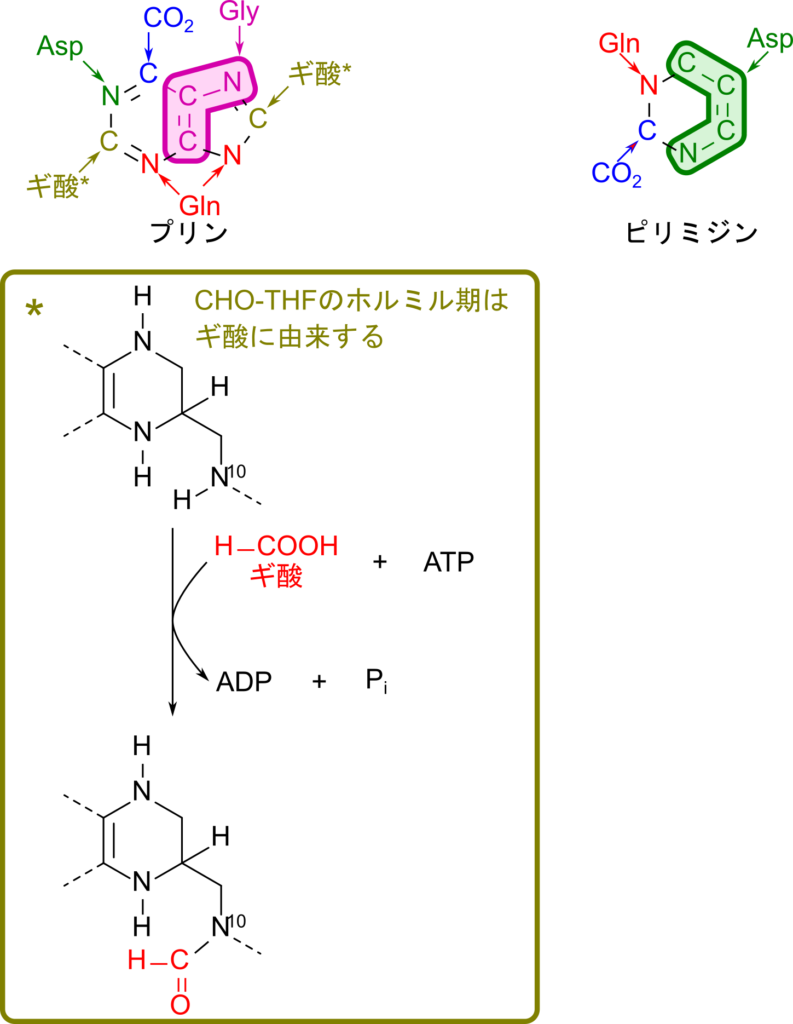
プリンヌクレオチドの各元素は以下のような由来をもっています(図2)。
- アミノ酸(グリシン、アスパラギン酸、グルタミン)
- 炭酸
- ギ酸 ※ギ酸は葉酸誘導体である CHO-THF を介して炭素を提供しています。
一方で、ピリミジンヌクレオチドの各元素は以下のような由来をもっています(図2)。
- アミノ酸(アスパラギン酸、グルタミン)
- 炭酸
以降ではこの点に注意して生合成経路を見ていきましょう(図2)。
プリンヌクレオチドの生合成経路
プリンヌクレオチドであるアデニル酸とグアニル酸の生合成経路を図3に示します(なお、各反応の詳細はこちらで解説しています)。
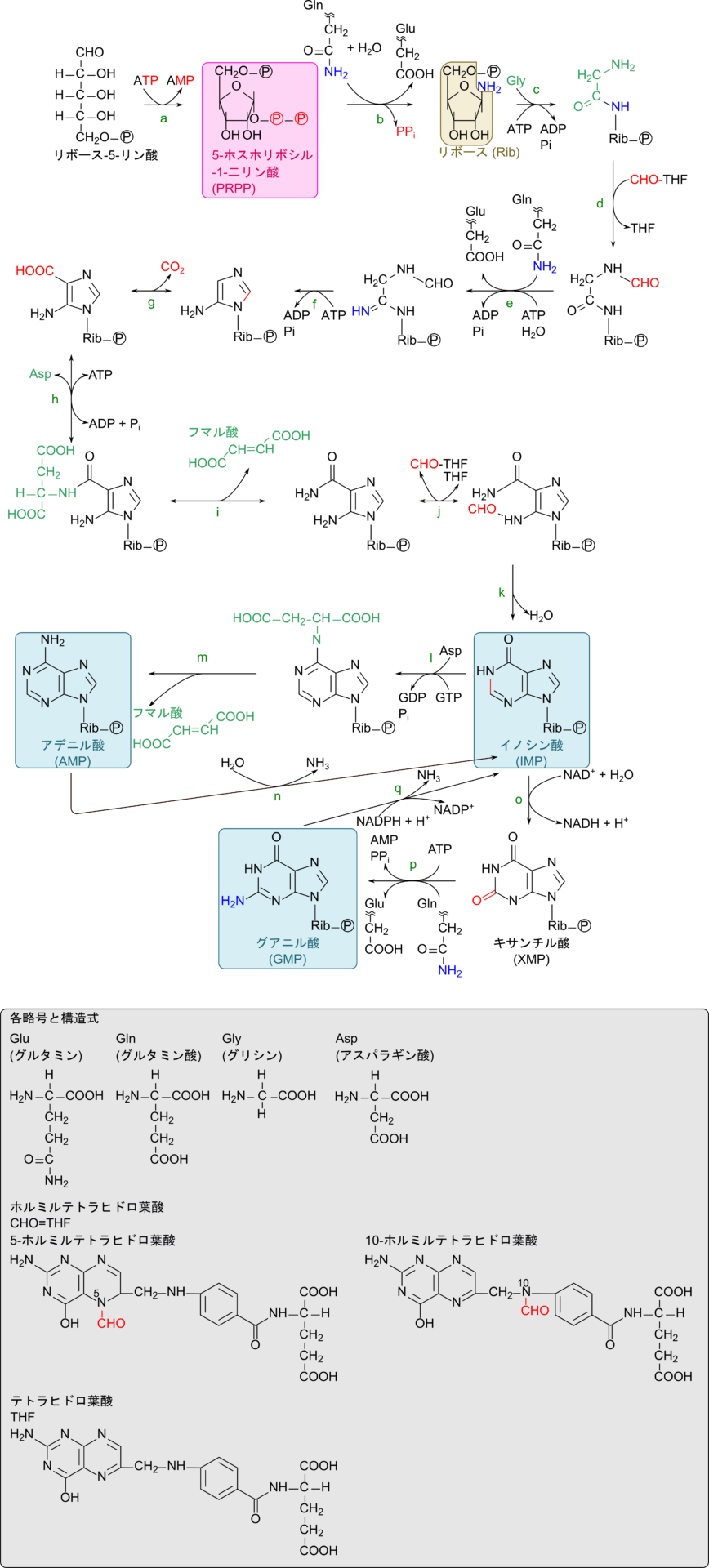
大変複雑な合成経路ですが、起こっている反応の種類はそれほど多くはありません。各反応について概観を見ていきましょう。
この経路は基本的に以下の二段階の反応の繰り返しです(反応 b, c, e, f, g, h, l, p の 8 反応)。
- リン酸基の転位による活性化
リン酸基のリン酸を酸素が攻撃して結合を形成し、リン酸基同士の結合が切断されます。 - 求核試薬による求核置換反応
アミノ基などの求核試薬により、カルボニル基の(δ+ 性を持つ)炭素原子が攻撃されて、無機リン酸と置換します。
c, e, f, g, h の反応はまさしくこのメカニズムで起こります。反応 l では ATP の代わりに GTP がリン酸基供与体として使用されています。反応 p ではリン酸基が転位するのではなく、AMP が転位されて活性化されます。b の反応ではまず反応 a により水酸基がリン酸化を受けて、反応 b で求核試薬による求核置換反応が進行しています。
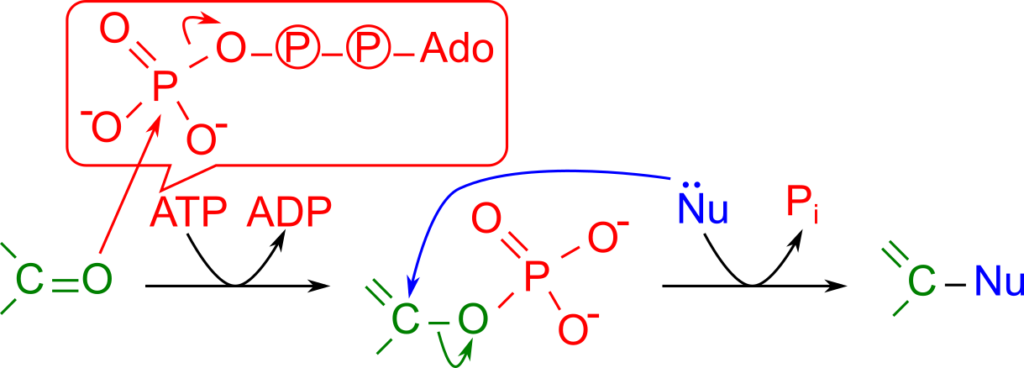
緑字:カルボニル(由来炭素)、赤字:リン酸(基)青字(Nu):求核試薬
残りの反応は以下の通りです。
反応 d、j は CHO-THF によるホルミル基(CHO-)の転位反応
反応 i、m はフマル酸の脱離反応
反応 k は脱水反応
反応 n(反応 l ~ m の逆方向)、q(反応 o ~ p の逆方向)は脱アミノ反応
反応 o は酸化反応
注)
THF はテトラヒドロ葉酸(tetrahydrofolic acid)の略です。THF は以下の置換基の転位反応を触媒する補酵素です。
・メチレン基(-CH2-)
・メチル基(-CH3)
・メチニル基(-CH=)
・ホルミル基(-CHO)
・ホルムイミノ基(-CH=NH)
反応 q では脱アミノと同時に酸化を受けています。
反応 l ~ m と反応 n、反応 o ~ p と反応 q は異なる経路です。いずれも単純な逆反応ではないので注意してください。
ピリミジンヌクレオチドの生合成経路
ピリミジンヌクレオチドであるウリジル酸の生合成経路とシチジル酸、チミジル酸の合成経路を図4に示します(なお、各反応の詳細はこちらで解説しています)。
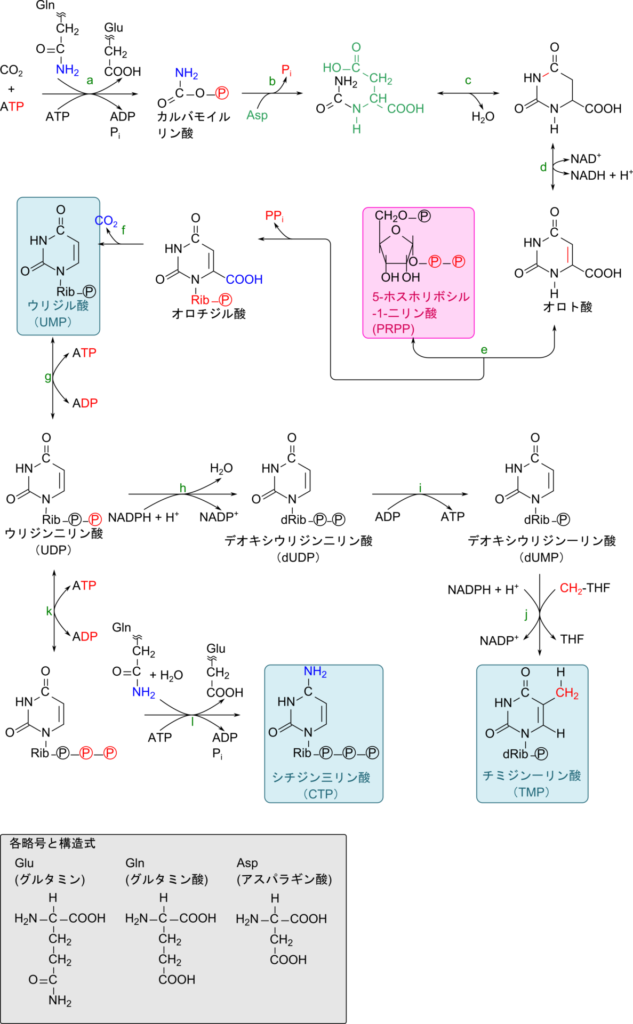
この反応経路もプリンヌクレオチドの生合成経路と同様で、基本的に以下の反応の繰り返しです(反応 a, b, e, l)。
- リン酸基の転位による活性化
リン酸基のリン酸を酸素が攻撃して結合を形成し、リン酸基同士の結合が切断されます。 - 求核試薬による求核置換反応
アミノ基などの求核試薬により、カルボニル基の(δ+ 性を持つ)炭素原子が攻撃されて、無機リン酸と置換します。
反応 a ~ b では反応 a でリン酸化まで、反応 b で求核置換反応が進行します。反応 e ではオロト酸のアミノ基が求核試薬として機能して、ピロリン酸が脱離しています。
残りの反応は以下の通りです。
反応 c では脱水反応
反応 d は酸化反応
反応 f は炭酸の脱離反応
反応 g、i、k はリン酸化または脱リン酸化
反応 h はリボヌクレオチドのデオキシリボヌクレオチドへの変換
※デオキシリボヌクレオチドの合成については次の項目で解説します
反応 j はCH2-THF によるメチレン基(-CH2-)の転位反応
※テトラヒドロキシ葉酸による転位反応は前の項目で説明しています
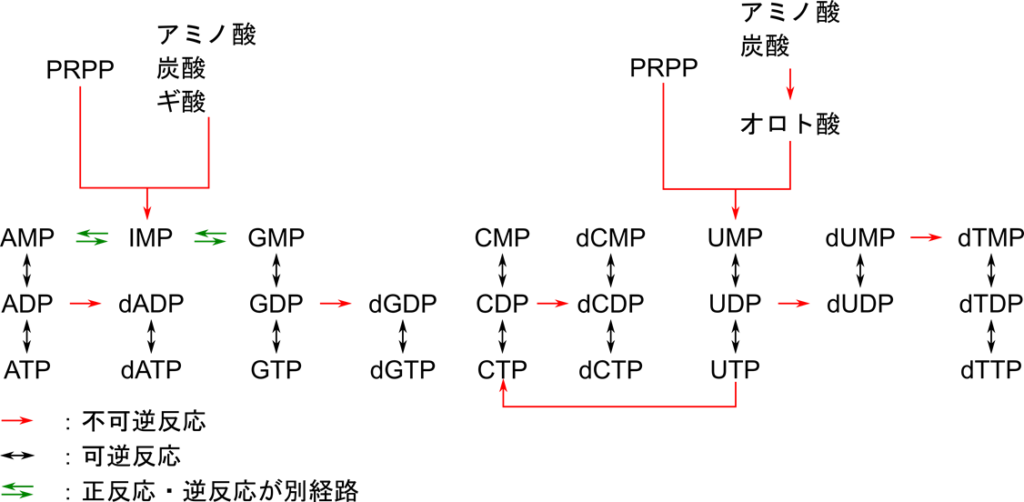
デオキシリボヌクレオチドの合成
図4の反応 h はリボヌクレオチドからデオキシリボヌクレオチドへの変換です。この反応は
UDP → dUDP
ADP → dADP
GDP → dGDP
CDP → dCDP
の四種類があります(図5)。
リボヌクレオチドからデオキシリボヌクレオチドへの変換はリボヌクレオチドレダクターゼによって触媒され、三つのシステインとグルタミン酸が関与して進行します(図6)。この反応は 2′ 位の水酸基から酸素が、二つのシステインから水素が提供されて水が脱離しています。その結果、二つのシステインはジスルフィド結合を形成します。このジスルフィド結合は NADPH により再び二つのシステイン残基へ還元されます(図7)。以上の内容をまとめると以下のようになります。
NADPH + H+ + NDP → NADP+ + dNDP + H2O
※NDP:リボヌクレオチド二リン酸
dNDP:デオキシリボヌクレオチド二リン酸
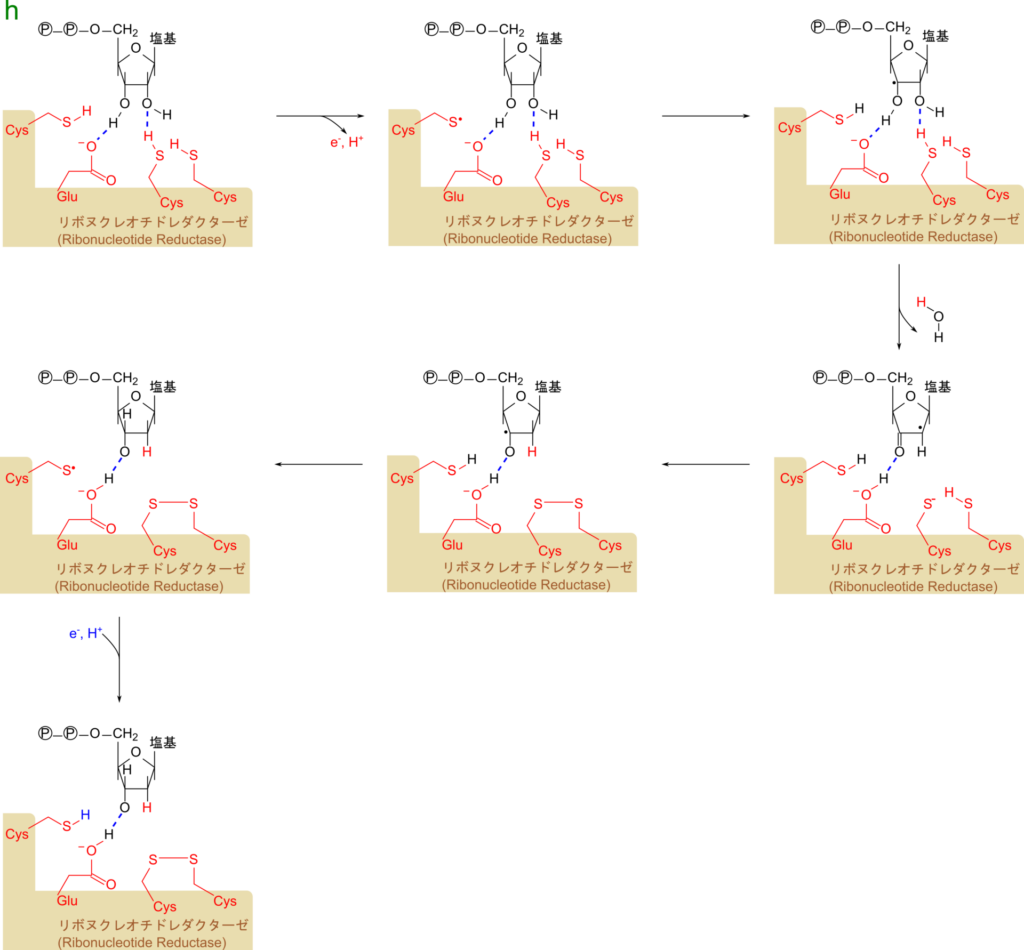
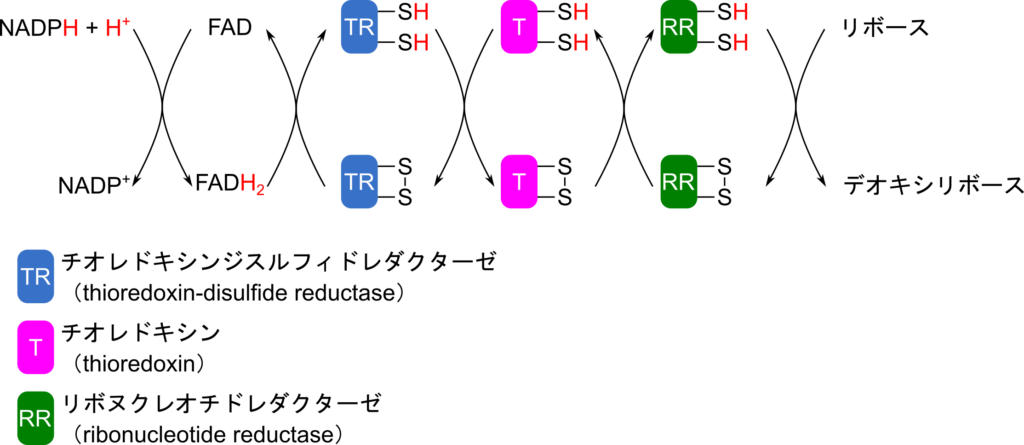
図6に示したリボヌクレオチドの還元に使用されるプロトンは NADPH から提供される。これらのプロトンは FAD、チオレドキシンジスルフィドレダクターゼ、チオレドキシン、リボヌクレオチドレダクターゼとリレーされて最終的にリボヌクレオチドの還元に使用されます。
サルベージ経路:ヌクレオチドのリサイクル経路
ヌクレオチドは分解される過程でリボースと切断されて塩基が産生されます。サルベージ経路ではこれらの塩基と 5-ホスホリボシル-1-二リン酸(PRPP)と反応してヌクレオチドへ変換され、リサイクルされます。この経路では ATP の消費が少ないため、生体内では多くのヌクレオチドがサルベージ経路によるリサイクルによって提供されています。

合成経路の制御
プリンヌクレオチド合成の制御
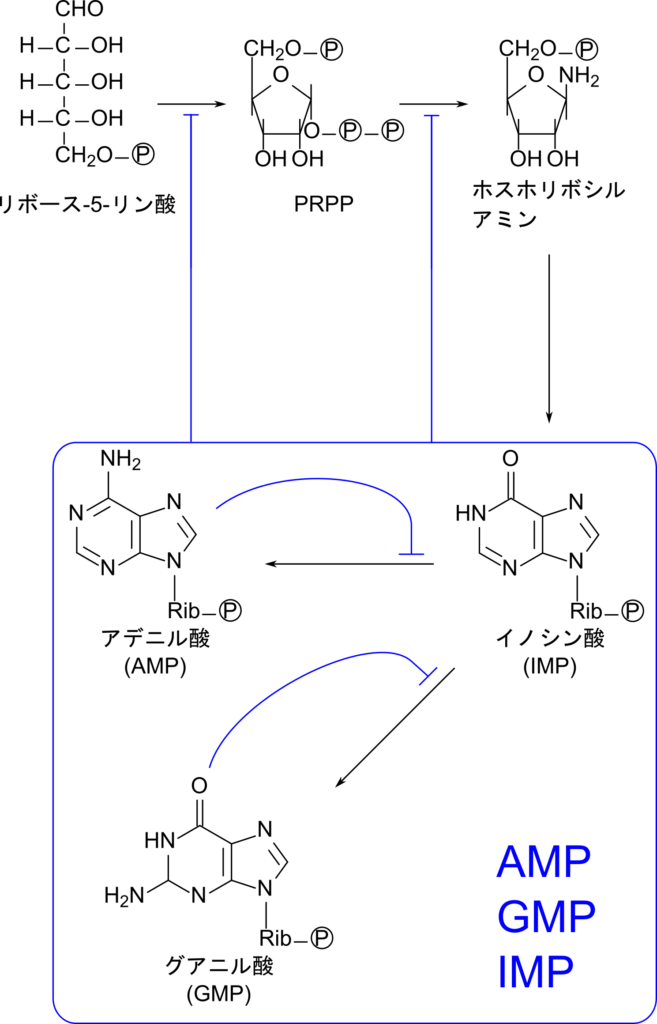
プリン塩基の合成は AMP や GMP によるフィードバック阻害を受けます。AMP と GMP はどちらも
リボース-5-リン酸 → PRPP
PRPP → ホスホリボシルアミン
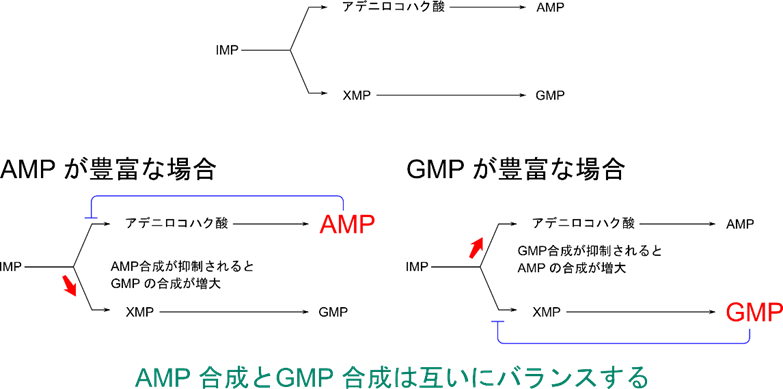
の反応を抑制して、プリン塩基合成性を制御します(図9)。一方で AMP は IMP から AMP の合成を、GMP は IMP から GMP の合成をそれぞれ制御します(図9、10)。この関係は AMP と GMP の合成のバランスをとっています。例えば、AMP の過剰生産により AMP の合成が阻害を受けると、IMP は余ってしまうので GMP の合成が多くなります。逆もまた同様で、GMP の合成がフィードバック阻害を受けると、AMP の合成が多くなります。
ピリミジンヌクレオチド合成の制御
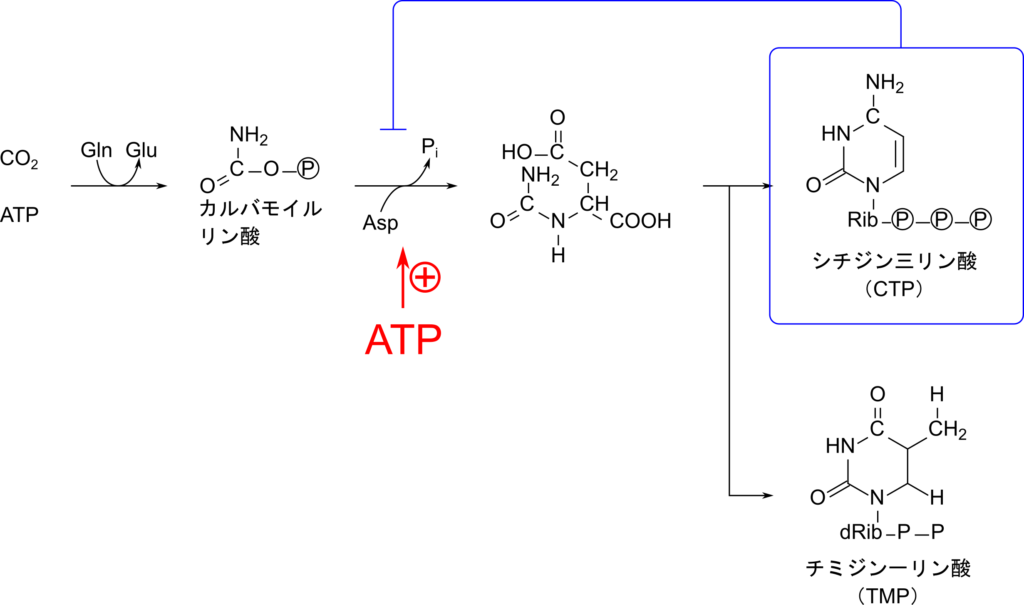
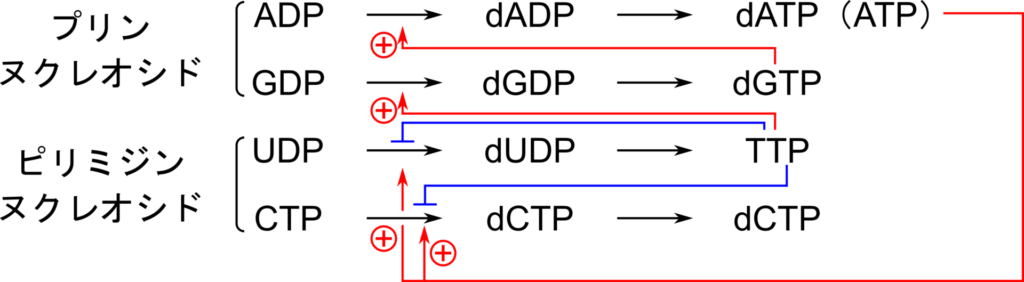
一方でピリミジン合成は CTP によってフィードバック阻害を、ATP によって正の制御を受けます。この制御はアスパラギン酸カルバモイルリン酸トランスフェラーゼ(Aspartate Transcarbamoylase;ATCアーゼ)に対して行われます。ATC アーゼはアロステリック酵素であり、CTP と結合すると高次構造の変化が生じて、活性が低下し、ATP と結合すると活性が高まります。
デオキシリボヌクレオチドの合成制御
リボヌクレオチドレダクターゼはアロステリック酵素です。ですので、活性中心のほかに制御因子が結合する部位(アロステリック部位)が用意されています。アロステリック部位は二種類あって、一方が全活性をコントロールする部位で、もう一方は基質特異的な活性の調節にかかわる部位です。
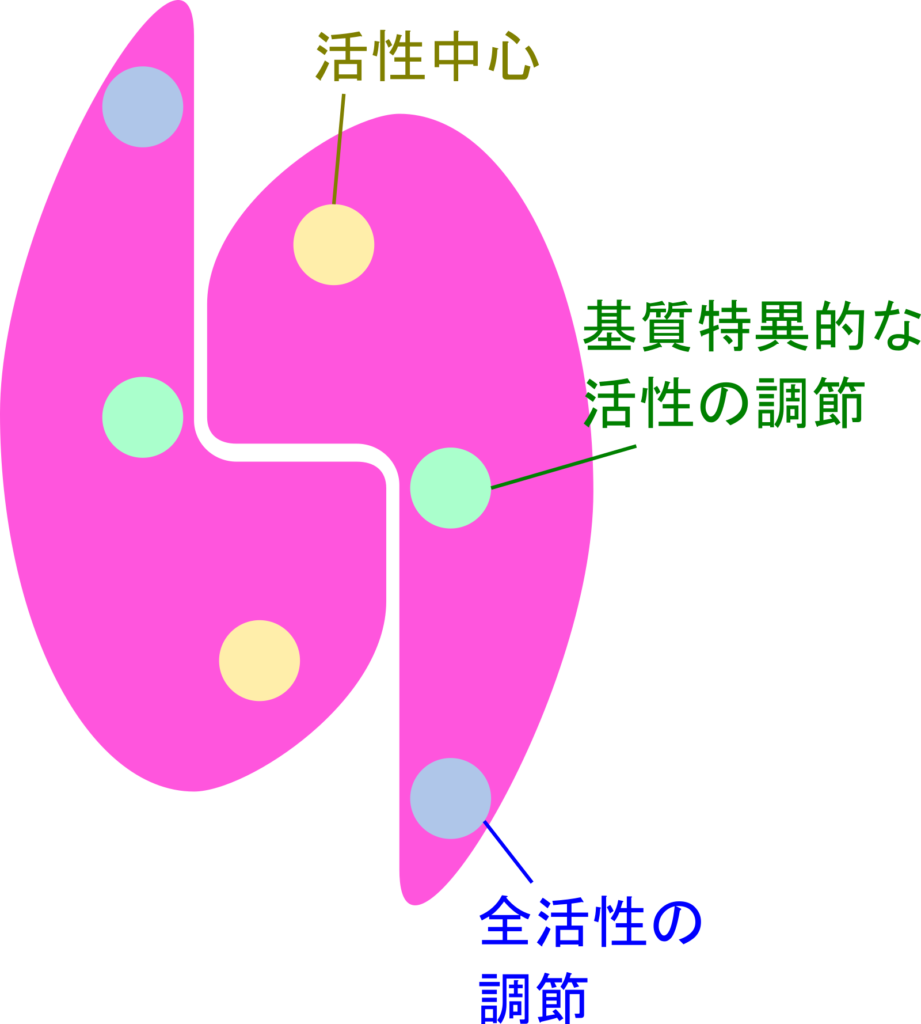
全活性を制御する部位では dATP が結合するとフィードバック阻害を受け、ATP が結合するとこの阻害が解除されます。
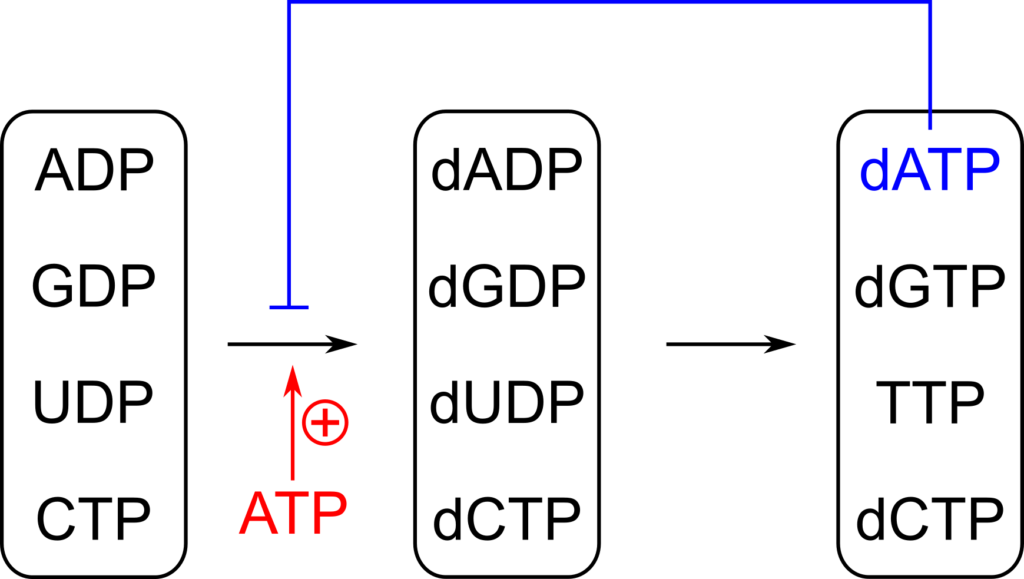
基質特異的な調節にかかわる部位では、以下のように反応がコントロールされます(図14)。
| dATP or ATP の結合 | CTP → dCTP の反応を促進 UDP → dUDP の反応を促進 |
| TTP の結合 | GDP → dGDP の反応促進 CTP → dCTP の反応阻害 UTP → dUTP の反応阻害 |
| dGTP の結合 | ADP → dADP の反応促進 |
これらの複雑な調節機構により、四つのデオキシリボヌクレオチドはバランスをとって供給されています。
今回はヌクレオチドの合成経路についてみてきました。ヌクレオチドは核酸を構成する基本単位でもありますが、エネルギーを仲介する ATP などにも利用される極めて重要な分子です。ヌクレオチドの合成経路はそれ自体が重要な反応経路でもありますが、一つ一つの反応にはリン酸化、求核置換反応、脱アミノ化など生化学で重要な反応メカニズムや、アロステリック酵素の制御など生化学でよく使う概念が多数含まれています。この点でヌクレオチドの合成経路、特に de novo 経路の理解は生化学の理解にとても有用でもありますので、ぜひ勉強してみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 224-264
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 694-717