以前の記事で酵素阻害について解説しました(酵素阻害剤の解説はこちら)。その際、反応速度の式の導出には触れませんでしたが、今回は詳しく解説します。数式を追うことで各阻害様式の特徴をより深く理解できるので、興味のある方はぜひご覧ください。なお、数式については代入する式と代入する個所や共通項でくくる際の共通項などを色分けして示していますので参考にしてください。
競合阻害
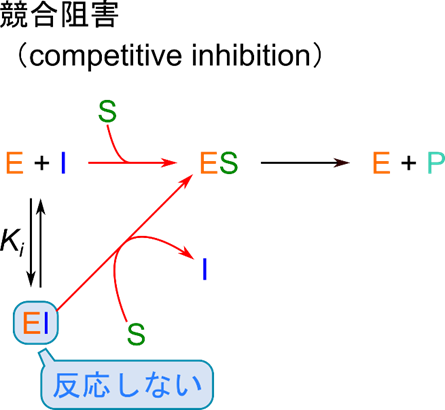
反応について確認しておきましょう。
酵素反応:![]()
k+1、k-1、k+2 は各反応の速度定数です。
酵素-阻害剤複合体形成反応: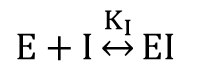
方針:
最初は [E] や [EI] を [ES] を使って表すことを目指します。そののち、得られた [E] や [EI] を
[E]0=[E]+[ES]+[EI]
に代入して [ES] について解きます。こうして得られた [ES] を V0=k+2[ES] に代入して整理することで 反応速度の式を得ます。以下に具体的な流れを確認していきましょう。
反応速度は単位時間当たりの生成物の濃度変化と定義できるので反応速度 V0 は![]() ・・・①
・・・①
また、解離定数を KI とおくと ・・・②
・・・②
一方で、初期酵素濃度を [E]0 とすると、これが [E]、[EI]、[ES]に分配されるので![]() ・・・③
・・・③![]() ・・・④
・・・④
①に④を代入すると![]()
定常状態では ES の変化量は 0 なので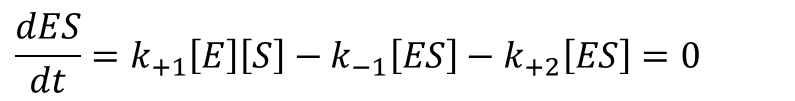
(※ dES/dt は ES 濃度の経時変化を時間で微分した関数を意味します。これはその瞬間におけるES 濃度変化量(=速度)を表します。) ・・・⑤
・・・⑤
②に⑤を代入すると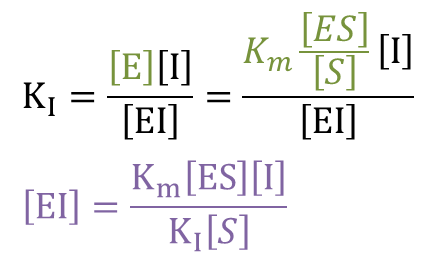 ・・・⑥
・・・⑥
⑤⑥を③に代入すると
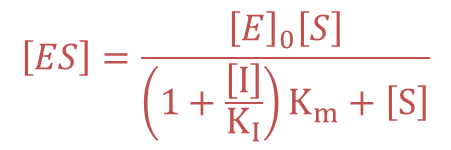 ・・・⑦
・・・⑦
①に⑦を代入すると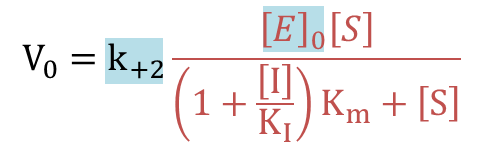
![]() なので
なので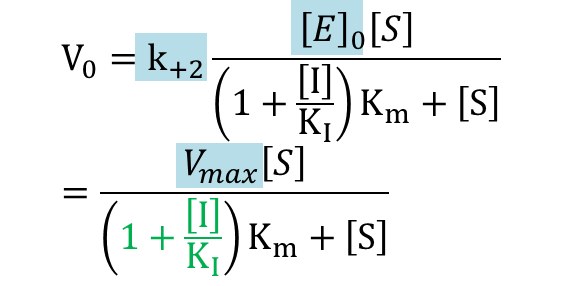
ここで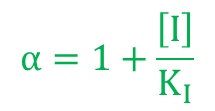 とおくと
とおくと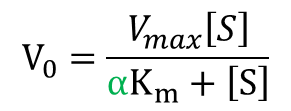
以上、競合阻害下の反応速度の式が導出されました。この式を通常の Michaelis-Meten の式と見比べましょう。すると、ミカエリス定数部分が αKm に置き換わっていることがわかります。したがって、
Kmapp=αKm
なお、この見かけ上(apparent)のミカエリス定数を Kmapp と記載します。このことから、競合阻害下では見かけのミカエリス定数が大きくなることがわかり、基質-酵素間の親和性が低下することがわかります。

不競合阻害
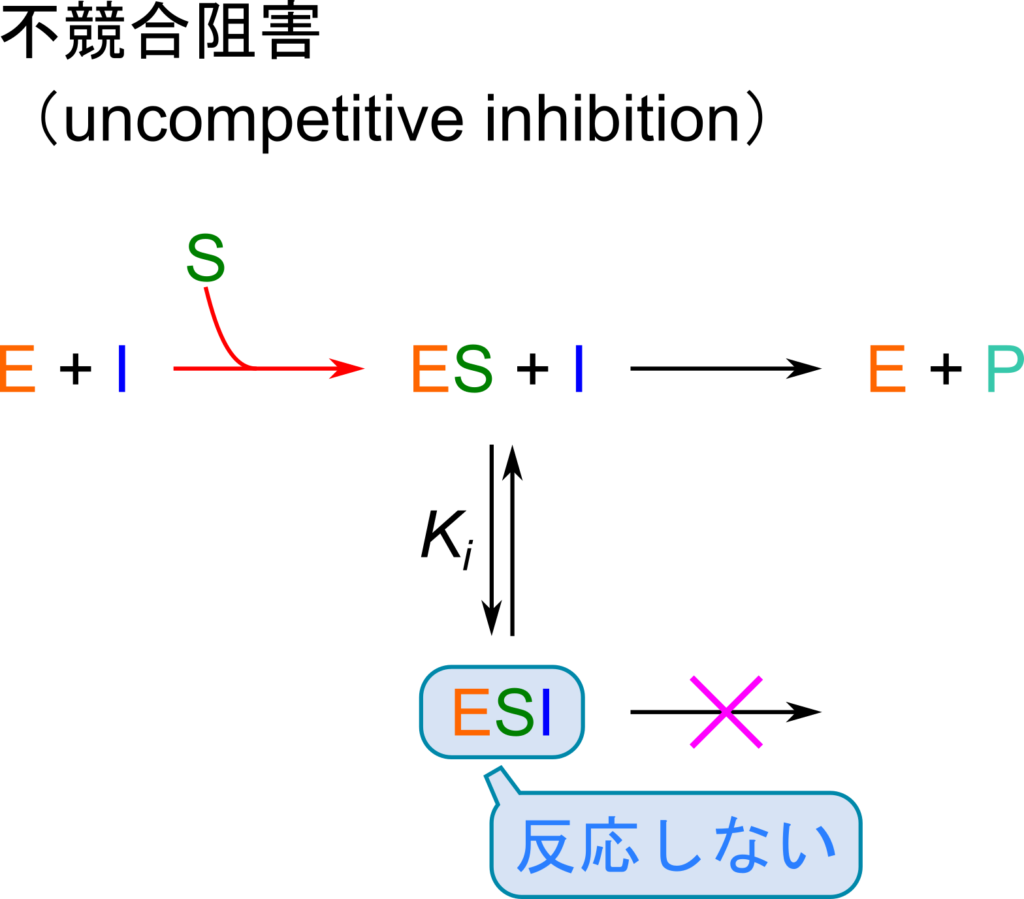
反応について確認しておきましょう。
酵素反応:![]()
k+1、k-1、k+2 は各反応の速度定数
酵素-阻害剤複合体形成反応:![]()
方針:
最初は [E] や [ESI] を [ES] を使って表すことを目指します。そののち、得られた [E] や [ESI] を[E]0=[E]+[ES]+[ESI] の式に代入して [ES] について解きます。こうして得られた [ES] を V0=k+2[ES] に代入して整理することで反応速度の式を得ます。以下に具体的な流れを確認していきましょう。
ここで解離定数 KI は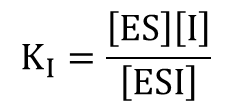
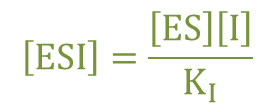 ・・・①
・・・①
定序状態では ES の変化量は 0 なので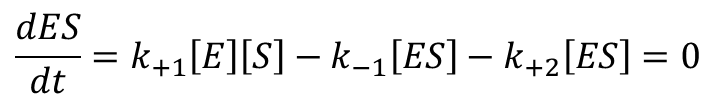
※ES は ESI の形成にも使用されるので、一見速度変化に ESI 濃度変化を考慮しないといけないように思うかもしれない。しかし、ES + I ⇆ ESI の反応は定常状態では平衡に達しているので、この反応による ES 濃度の変化はありません。したがって、ESI 複合体形成が酵素反応の反応速度に影響することはなく、ここでは無視しています。
したがって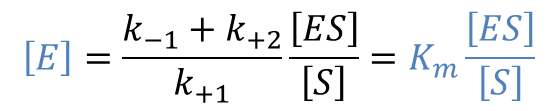 ・・・②
・・・②
初期酵素濃度を [E]0 とすると、これが [E]、[ESI]、[ES]に分配されるので![]() ・・・③
・・・③![]() ・・・④
・・・④
反応速度は単位時間当たりの生成物濃度変化なので![]() ・・・⑤
・・・⑤![]() ・・・⑥
・・・⑥
⑥ に ①② を代入すると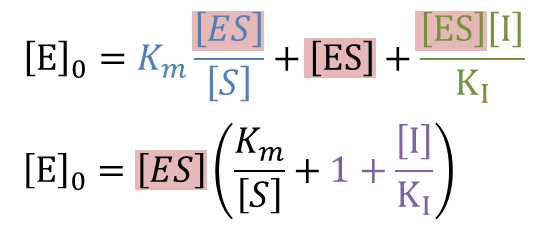
ここで、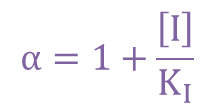
とすると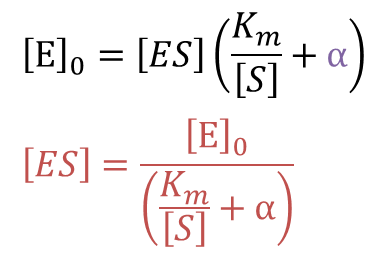 ・・・⑧
・・・⑧
⑧ を ⑤ に代入すると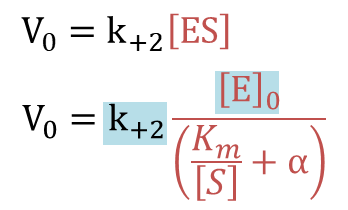
ここで![]()
なので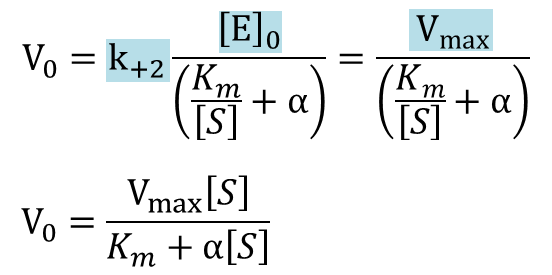
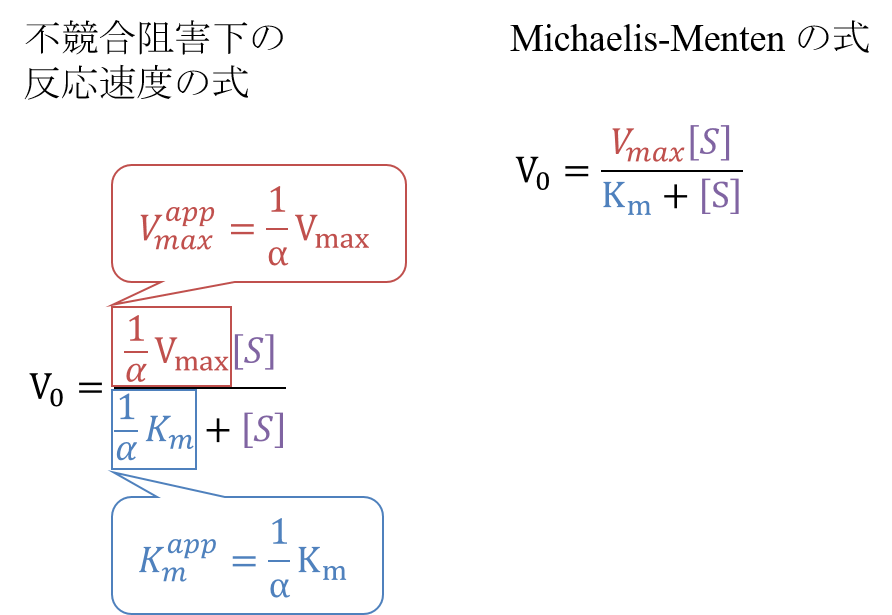
以上、不競合阻害下における反応速度の式が導出されました。この式を
さらに変形すると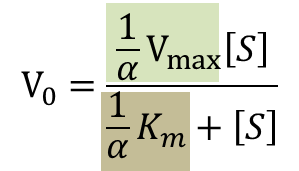
となります。この式をMichaelis-Menten の式と見比べると、ミカエリス定数部分が 1/αKm に、Vmax 部分が 1/αVmax に置き換わっていることがわかります。
Kmapp = 1/αKm
Vmaxapp = 1/αVmax
となります。このことから、反競合阻害では見かけのミカエリス定数と Vmax が低下します。
非競合阻害
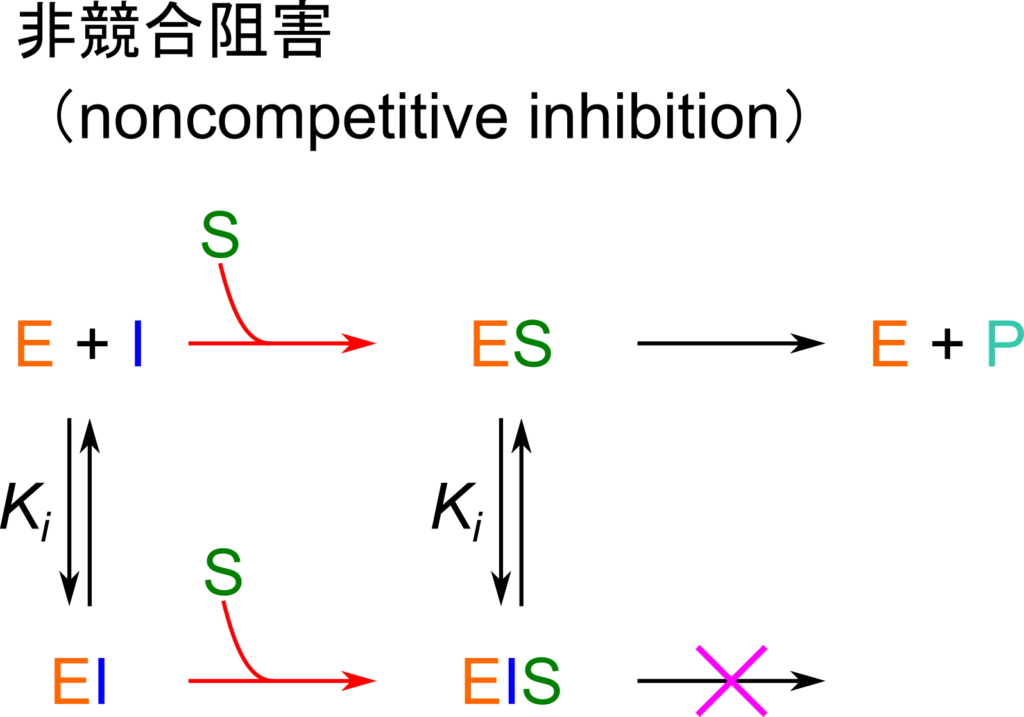
酵素反応:![]()
複合体形成反応: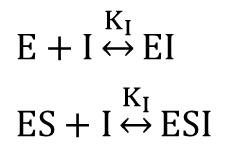
※ KI はどちらの反応でも共通
方針:
最初は [E] や [EI]、[ESI] を [ES] を使って表すことを目指します。そののち、得られた [E] や [EI]、[ESI] を[E]0=[E]+[ES]+[EI]+[ESI] の式に代入して [ES] について解きます。こうして得られた [ES] を V0=k+2[ES] に代入して整理することで反応速度の式を得ます。以下に具体的な流れを確認していきましょう。
ここでミカエリス定数 Km と解離定数 KI は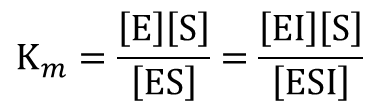 ・・・①
・・・①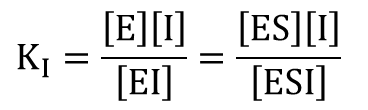 ・・・②
・・・②
① より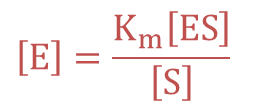 ・・・③
・・・③
② に ③ を代入すると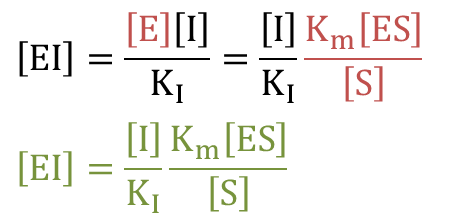 ・・・④
・・・④
一方で ② より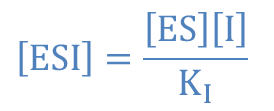 ・・・⑤
・・・⑤
初期酵素濃度を [E]0 とすると、これが [E]、[EI]、[ES]、[ESI]に分配されるので![]() ・・・⑥
・・・⑥
⑥ に ③~⑤ を代入して
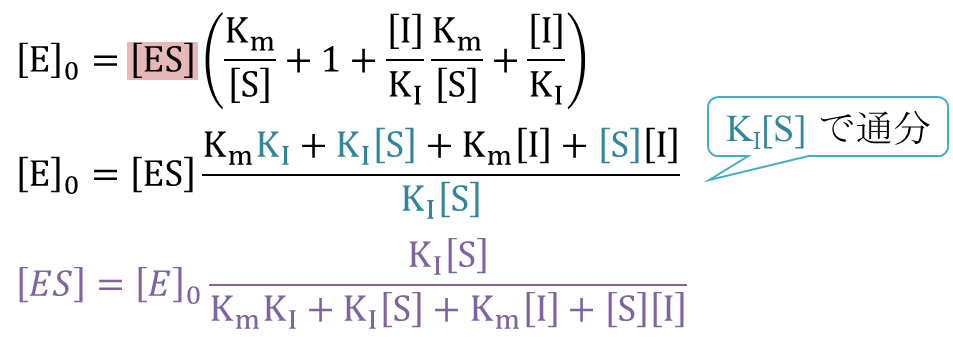 ・・・⑦
・・・⑦
反応速度は単位時間当たりの生成物濃度変化なので![]() ・・・⑧
・・・⑧
⑧ に ⑦ を代入すると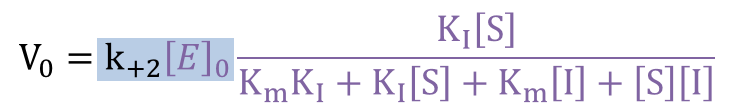
ここで、![]()
なので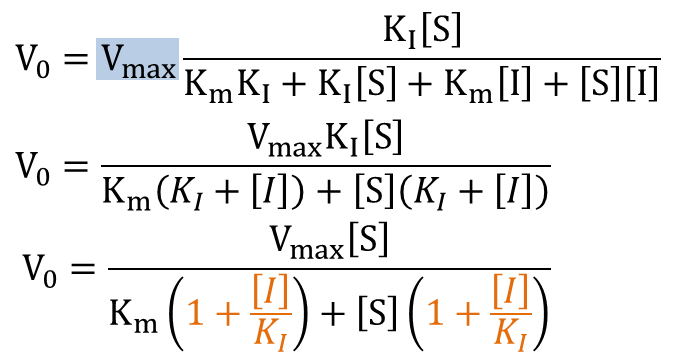
さらに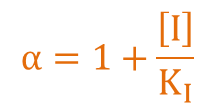
とおくと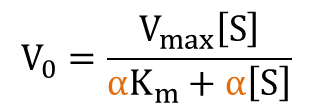
となり、反応速度の式が導出されました。さらに変形すると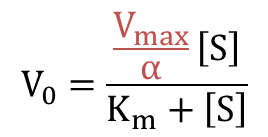
となります。この式をMichaelis-Menten の式と見比べると、Vmax 部分が 1/αVmax に置き換わっていることがわかります。ですから、
Vmaxapp = 1/αVmax
となります。このことから、非競合阻害では Vmax が減少することがわかります。
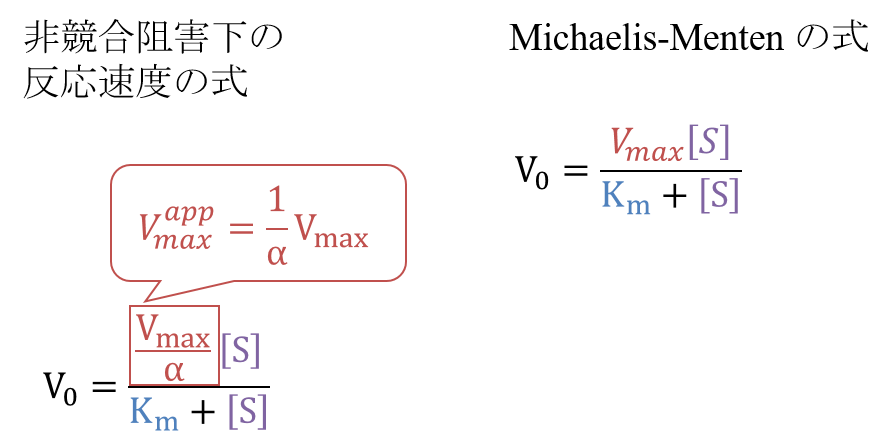
非競合阻害(混合阻害)
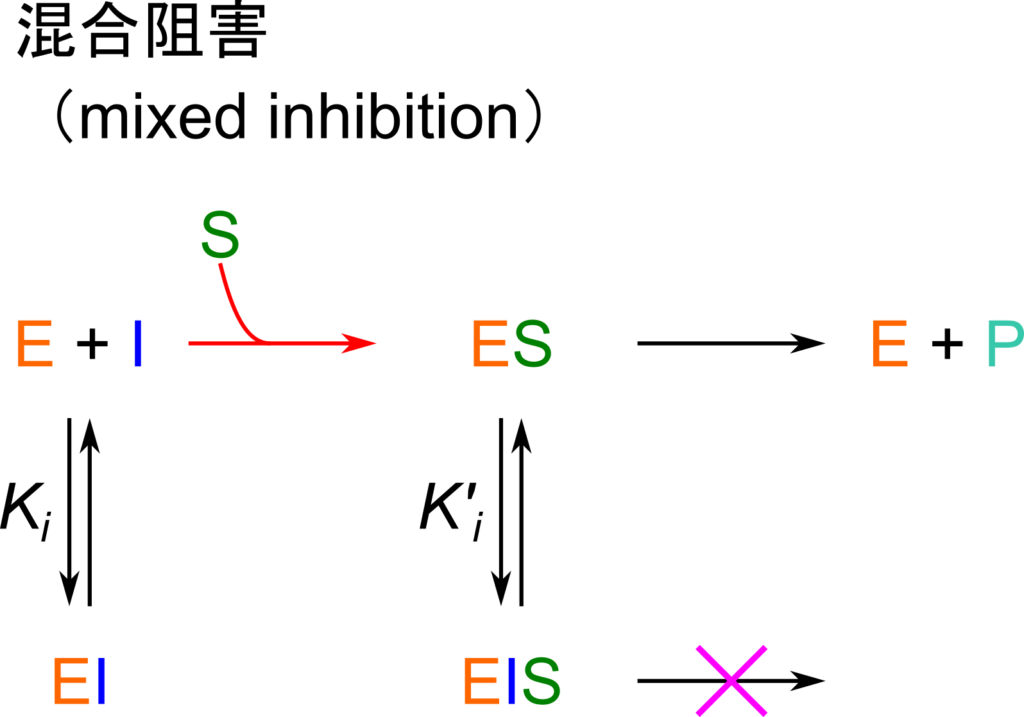
混合阻害(mixed inhibition)では E + I ⇆ EI の解離定数と ES + I ⇆ ESI の解離定数が異なる場合を取り扱います。実は上述の非競合阻害は混合阻害の特殊な事例を扱っています。ここでは混合阻害の Michaelis-Menten の式を導出してみます。参考にしてみてください。
方針:
基本的な戦略は非競合阻害と同様です。ただし、KI と K’I が異なるのでこの点に注意して計算をする必要があります。この点に留意して、以下に具体的な流れを確認していきましょう。
酵素反応:![]()
EI あるいは ESI 複合体形成反応:![]()
![]()
ここでミカエリス定数 Km と解離定数 KI、K’Iは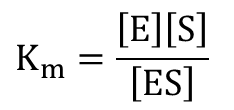 ・・・①
・・・①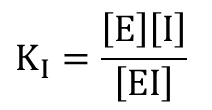 ・・・②
・・・②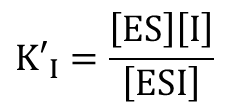 ・・・③
・・・③
![]()
① より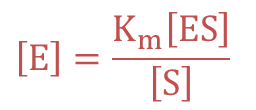 ・・・④
・・・④
② を変形して ④ を代入すると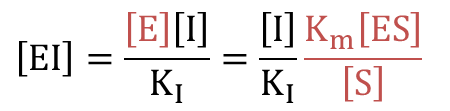
したがって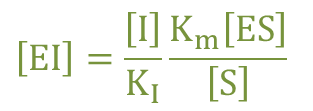 ・・・⑤
・・・⑤
を得る。一方で ③ より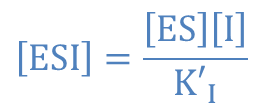 ・・・⑥
・・・⑥
初期酵素濃度を [E]0 とすると、これが [E]、[EI]、[ES]、[ESI]に分配されるので![]() ・・・⑦
・・・⑦
⑦ に ③~⑤ を代入して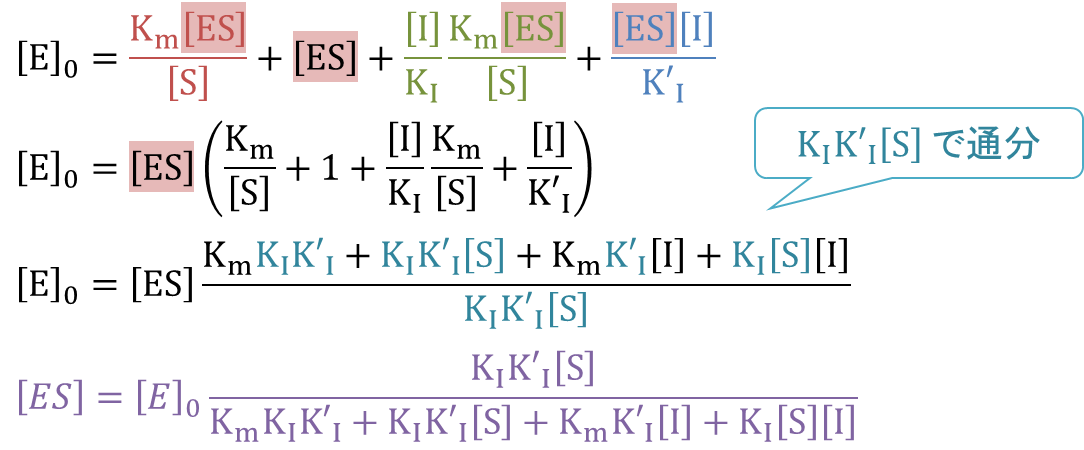 ・・・⑧
・・・⑧
反応速度は単位時間当たりの生成物濃度変化なので![]() ・・・⑨
・・・⑨
⑨ に ⑧ を代入すると
![]() なので
なので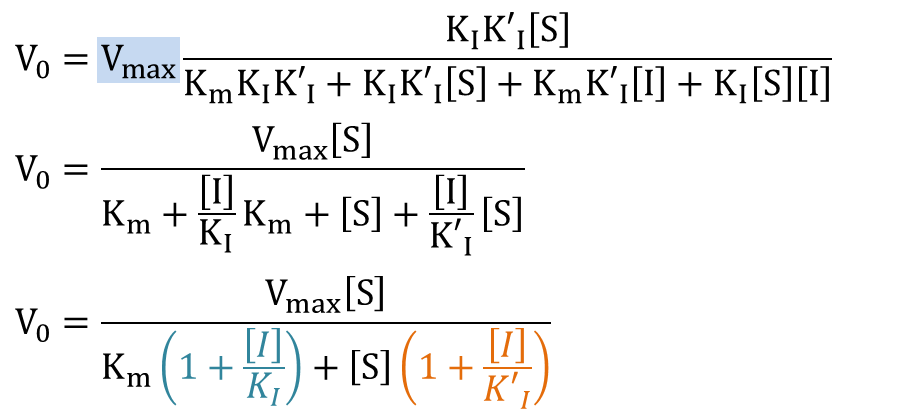
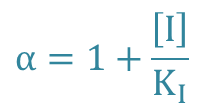 ,
, 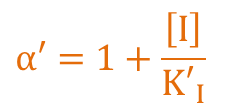 とおくと
とおくと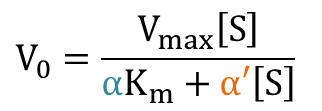
となり、反応速度の式が導出されました。さらに変形すると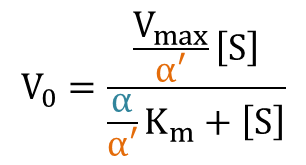
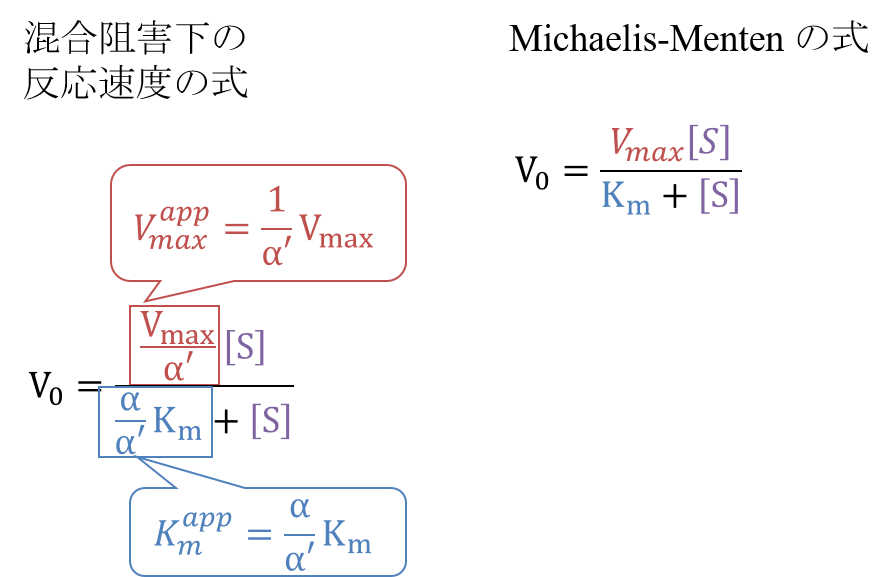
この式をMichaelis-Menten の式と見比べると、Km とVmax 部分がそれぞれ α/α’ Km と 1/α’ Vmax に置き換わっていることがわかります。ですから、
Kmapp = α/α’ Km
Vmaxapp = 1/α’ Vmax
となります。このことから、見かけのミカエリス定数は KI < K’I なら大きく、KI > K’I なら小さくなります。一方で見かけの Vmax は減少します。
続いて Lineweaver Burk プロットについて考察してみます。まずは反応速度の式の逆数をとりましょう。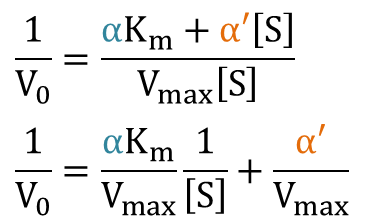
これが、Lineweaver Burk プロットの式です。さらに、x 切片を求めてみましょう。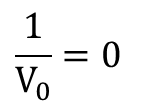 を仮定して
を仮定して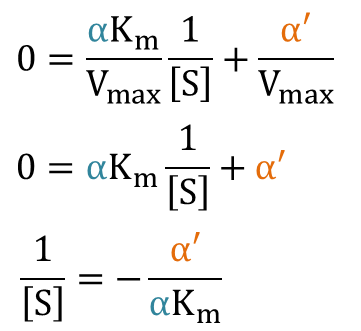
よって、X 切片、Y 切片、傾きはそれぞれ
X 切片: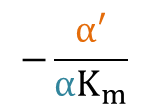
Y 切片: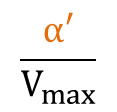
傾き: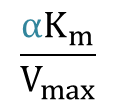
ところで, 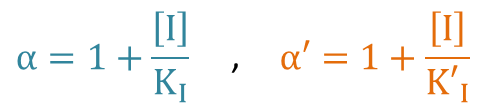 を代入すると
を代入すると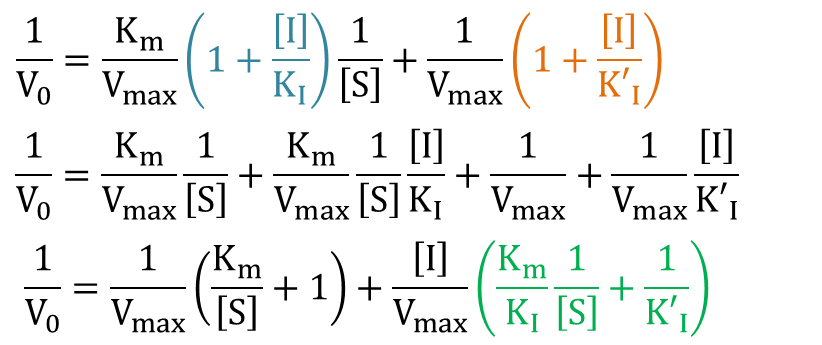
ここで、[I] の係数が 0 となるような 1/[S] では、1/V0 は [I] に無関係に決まります。そこで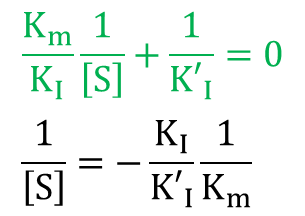 ・・・⑨
・・・⑨
ところで、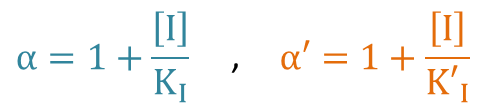 から、
から、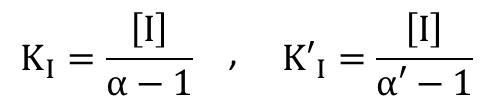
これらを⑨に代入すると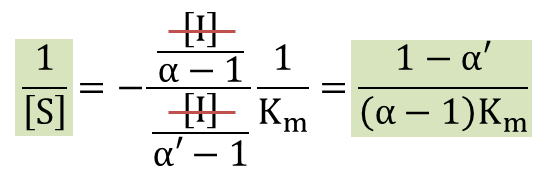
この時、1/V0 は
したがって Lineweaver Burk プロットは [I] にかかわらず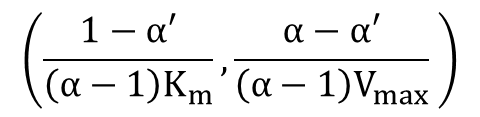
を必ず通ります。
ここで、α=α’ の時を考えると、
X 切片: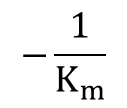
Y 切片: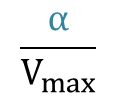
傾き: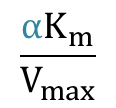
となり、非競合阻害の Lineweaver Plot(詳細はこちら)と一致します。なお、α=α’ (つまり、KI=K’I)として計算すると![]() は X 切片と一致することも確認できます。このことから非競合阻害は
は X 切片と一致することも確認できます。このことから非競合阻害は![]() 、
、![]() の解離定数 KI とK’I が等しいときの混合阻害とみなせます。
の解離定数 KI とK’I が等しいときの混合阻害とみなせます。
今回は各阻害剤の Michaelis-Menten の式を導出して、最後に混合阻害について少し触れてみました。これらの内容は、少し深い内容になりますので、酵素阻害剤の紹介(記事はこちら)では紹介しませんでした。ですが、この内容には各阻害様式がどのように酵素を阻害するものなのかというポイントが含まれているため、この内容を理解することで、酵素阻害をよりしっかりした理解ができます。余力のある方はぜひチャレンジしてみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 92-122
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.198-262
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.242-264 Raymond Chang 著、岩澤康裕・北川禎三・濱口宏夫約訳 (2003) .
- 化学・生命科学系のための物理化学. 東京化学同人. pp.324 – 356