私たちの体では、酵素が化学反応を制御しています。ある種の酵素の機能を停止させることで酵素の機能を解析したり、化学反応を制御して病気の治療に応用するなど、酵素阻害剤は医療やバイオテクノロジーに欠かせない存在です。本記事では、酵素阻害剤の作用機序や機能の仕方をわかりやすく解説します。
Contents
阻害剤の概要
酵素はある種の分子によって活性が阻害される場合があります。酵素阻害剤は人為的にデザインして作られたものや偶然に発見されたものが多く、薬剤や毒物など広く様々に応用されている物質です。特に、生命科学の研究においては酵素の作用機序を研究する場合によく使用されます。
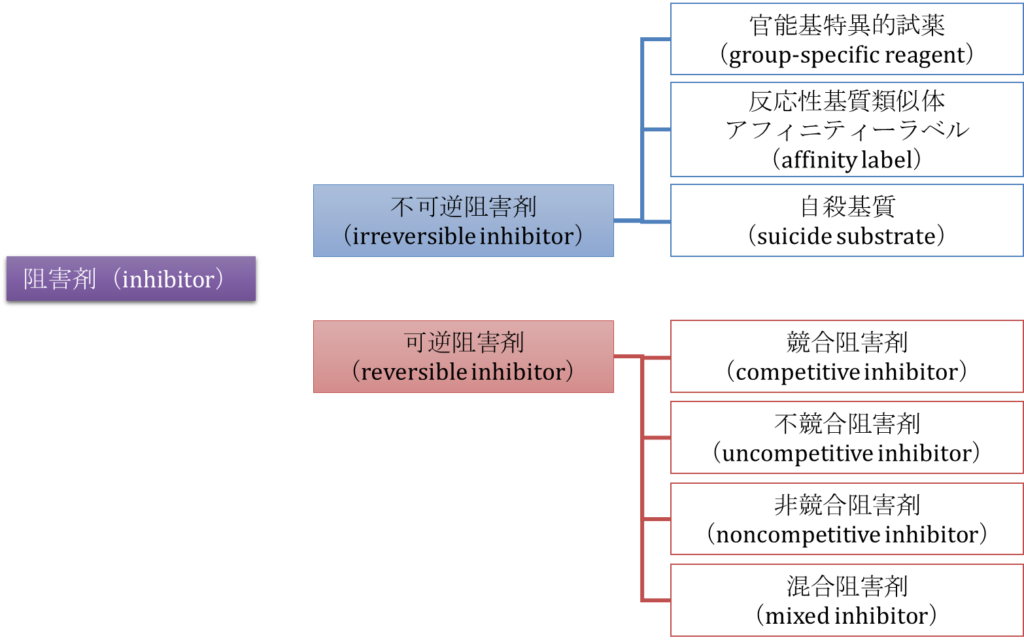
酵素阻害剤には不可逆阻害剤(irreversible inhibitor)と可逆阻害剤(reversible inhibitor)に分類できます。その名の通り、不可逆阻害剤は酵素と強く結合するため極めて解離しにくい阻害剤で、阻害作用が不可逆的になります。ペニシリン(細菌のペプチド転移酵素と共有結合して細胞壁の合成を妨げる抗生物質)やアスピリン(シクロオキシゲナーゼと共有結合して炎症時のシグナル分子の合成を阻害)などがこれに当たります。不可逆阻害剤には官能基特異的試薬、反応性基質類似体(アフィニティーラベル)、自殺基質といったものがあります。
可逆阻害剤は酵素と阻害剤がすぐに解離するという特徴があります。可逆阻害剤には競合阻害剤、不競合阻害剤、非競合阻害剤、混合阻害剤などがあります。不競合阻害剤と非競合阻害剤は名前は似ていますが内容は異なる阻害剤なので気を付けてください。
阻害剤を考える場合、どのような複合体が形成されるのかが重要になります。このような議論をする際に酵素、基質、阻害剤をアルファベットで表記する場合が多々あります。酵素は Enzyme なので “E”、基質は Substrate なので ”S”、阻害剤な Inhibitor なので “I” で表記します。この表記方法はこの記事でも使用しますので覚えておいてください。
可逆阻害剤
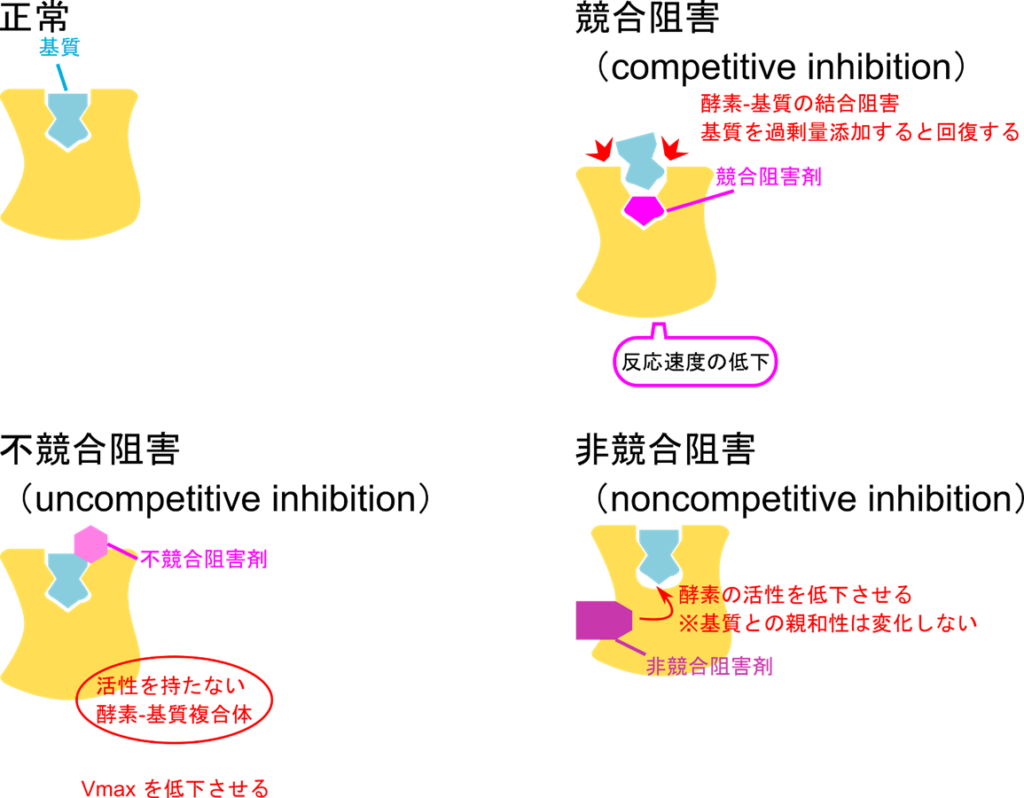
可逆阻害剤の分類のイメージを図2に示します。可逆阻害には競合阻害、不競合阻害、非競合阻害があります。のちに詳述しますが、競合阻害は基質と阻害剤が酵素を取り合うようなものを言います。不競合阻害は ES 複合体に阻害剤が結合することにより活性を抑制するものを言います。非競合阻害では酵素や ES 複合体に結合することで反応を阻害するものを言います。混合阻害は非競合阻害の中でも、酵素と阻害剤が結合するときの解離定数と ES 複合体と阻害剤が結合するときの解離定数が異なる複雑なものを言います。
競合阻害剤
作用機序
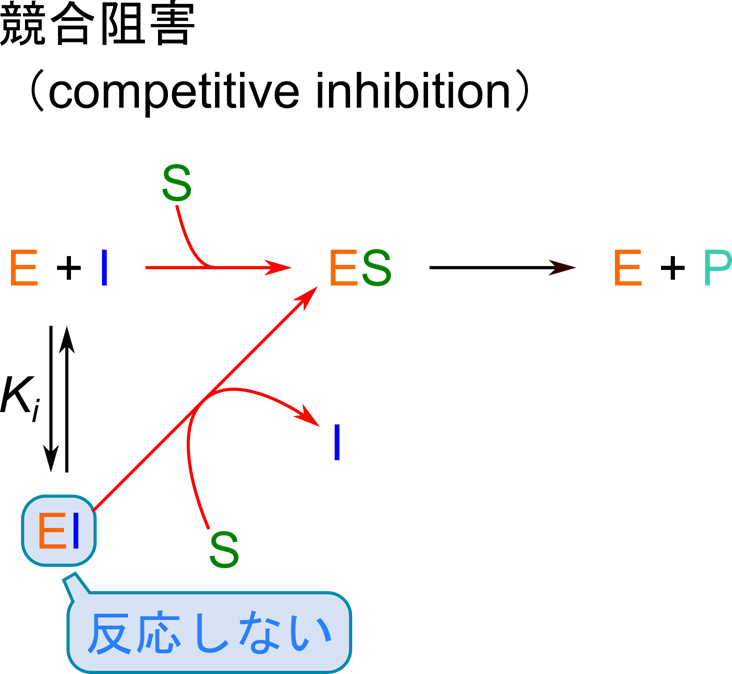
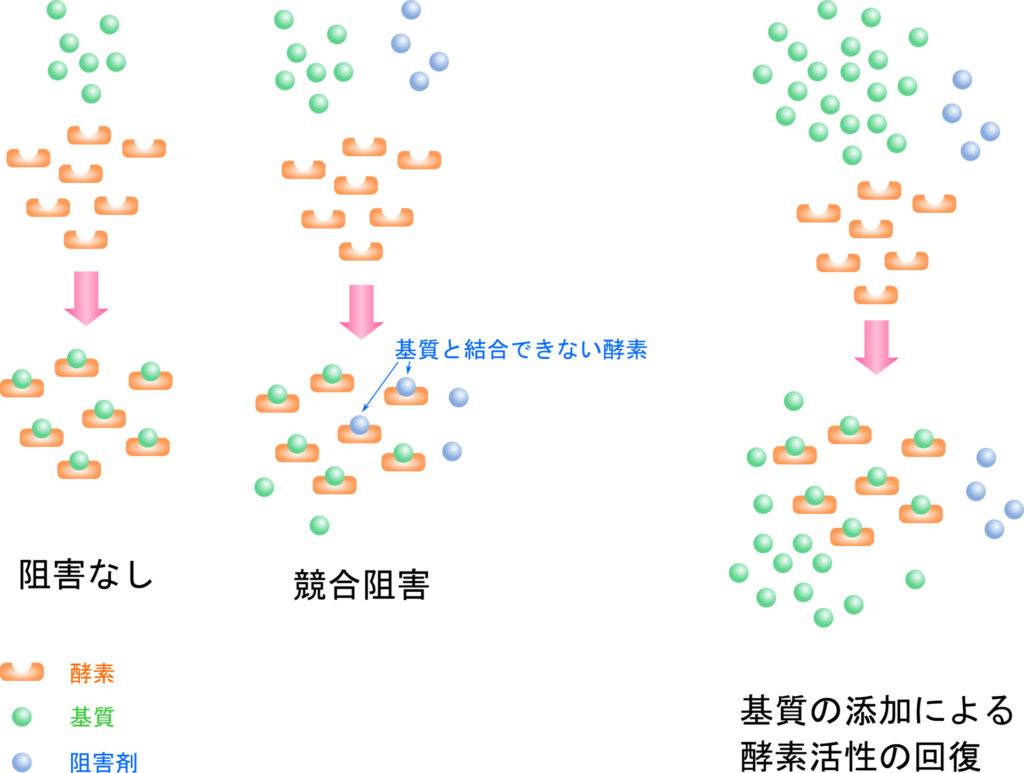
競合阻害剤は基質と似た構造を持ち、活性部位に結合して EI 複合体を形成することができます。この時、阻害剤が結合されている場合には基質は結合できません(図3)。競合阻害はいわば基質と阻害剤の酵素争奪戦です。阻害剤が酵素と結合することで、ES 複合体を形成できる酵素の割合を減少させ、触媒反応の速度を低下させます(図4)。取り合いをするわけですので、基質濃度を上昇させて基質に有利な状態を作ればこの阻害は弱まっていきます。
反応速度論
競合阻害剤の場合、酵素と結合して EI 複合体を形成します(図3)。この反応は平衡反応ですので、解離定数 KI は以下の通りです。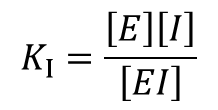
ところで競合阻害の条件下ではミカエリス-メンテン の式から以下のような式を得ることができます。 ・・・①
・・・①
ここで、α は以下のように定義されます。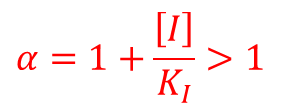 ...②
...②
①に注目すると、ミカエリスメンテンの式の Km の個所が αKm に置き換わっています。αKm を見かけのミカエリス定数(Kmapp)*とみなすことができます。Kmapp は以下の通りです。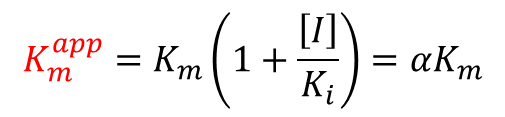
![競合阻害で [S] に対してV0は小さくなるものの、[S] を増加させていくとV0はいずれ Vmax に到達する](https://www.lifescience-note.net/wp-content/uploads/2025/02/image-60.png)
②の式に注目してください。 明らかに [I]/KI >0 ですので、α=1+[I]/KI>1 となり、 ![]()
となります。このことから、競合阻害はミカエリス定数を上昇させることがわかります。
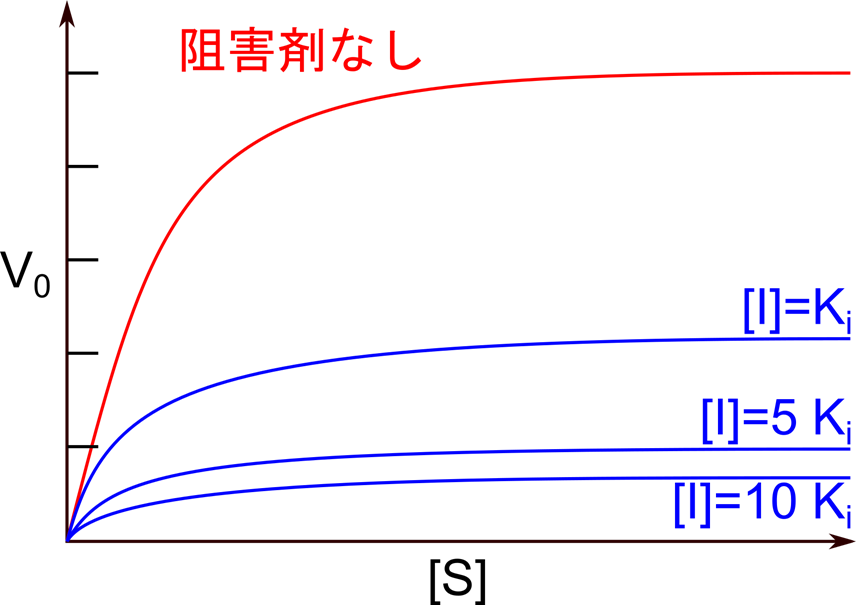
ここで、基質濃度 [S] と反応速度 V0 の関係を見ていきましょう。競合阻害では阻害剤濃度が上がるにしたがって、グラフの立ち上がりが緩やかになっていきます。ただし、[S] 濃度を高めていくと阻害の効果は弱まっていき、やがては Vmax に到達することになります。このように [S] 濃度を上昇させることにより、阻害の効果が弱まることは競合阻害の特徴です。
![Lineweaver Burk プロットではY切片は一定であるが、[I]が増大するにしたがって傾きが増大する](https://www.lifescience-note.net/wp-content/uploads/2025/02/image-61.png)
さらに、Lineweaver Burk プロットについてみていきましょう。Michaelis-Menten の式から、Lineweaver Burk プロットの式は簡単に導けます。
・・・(Micaelis-Menten の式)
この式の両辺を逆数にすると Lineweaver Burk プロットの式が得られます。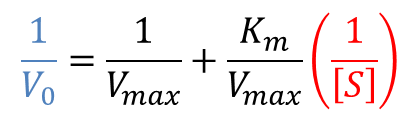
今、競合阻害剤存在下では見かけの Km が Kmapp になっていますので、上の式の Km を Kmapp に書き換えます。 ・・・③
・・・③
さらに、Kmapp は以下のように表されます。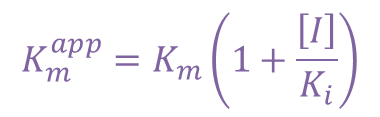
この式を③に代入すると、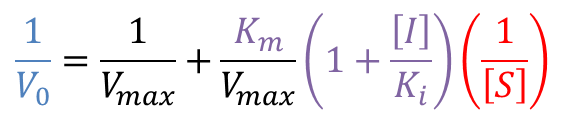
となります。ここで、傾き部分を抜き出すと、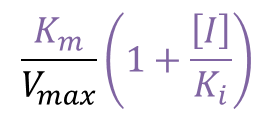
となり、したがって、[I] が増大すると傾きが増大することがわかります。したがって、Lineweaver Burk プロットのグラフは [I] が増大するほど傾きが大きくなります。一方で、Y切片は 1/Vmax であり、[I] と無関係ですので [I] を変化させても変わりません。
*: Kmapp やのちに出てくる Vmaxapp の “app” は apparent(見かけ上の)の意味です
不競合阻害
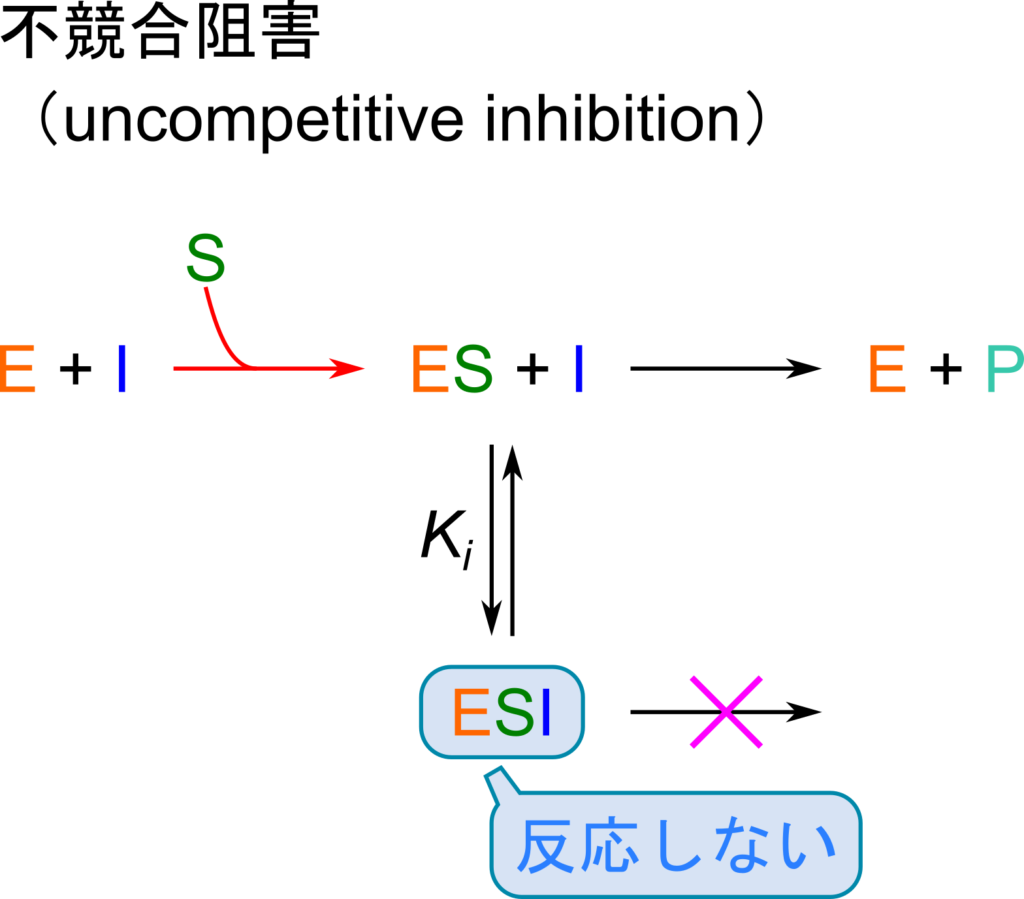
作用機序
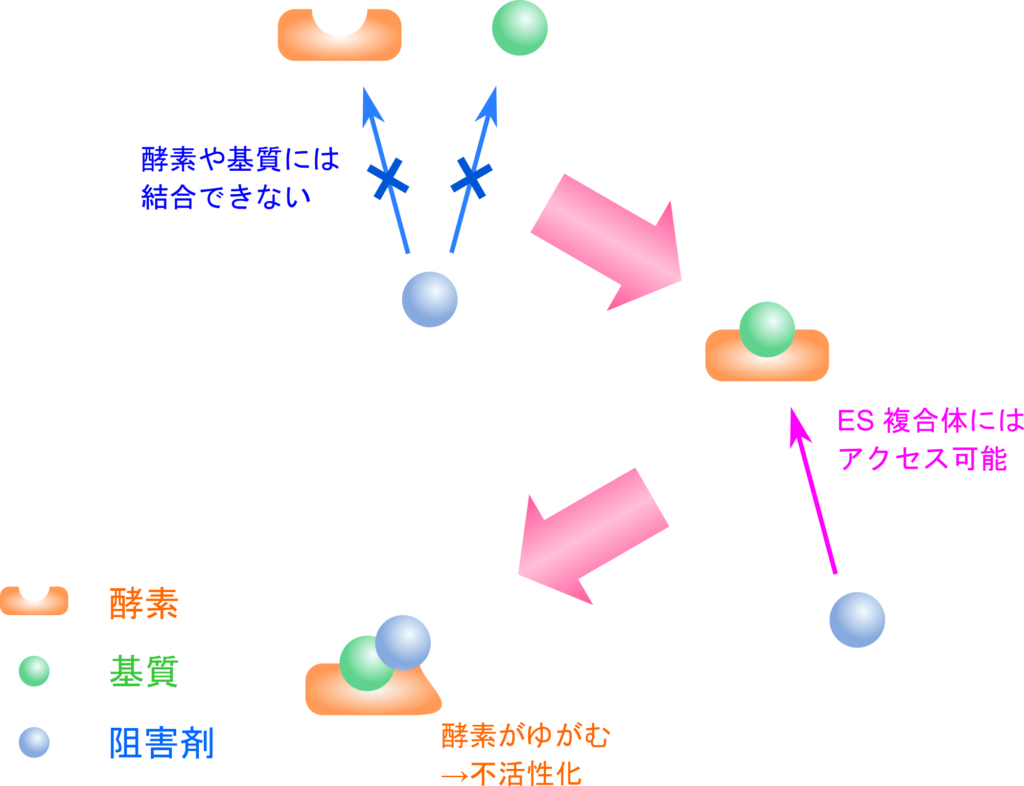
不競合阻害は ES 複合体と結合して活性部位をゆがませて酵素を不活性化します。この阻害剤は ES 複合体の活性部位と基質にわたって結合するため、阻害剤結合部位が ES 複合体が形成されて初めて形成されます。ですので、 ES 複合体とのみ結合でき、酵素や基質単体とは結合できません。この阻害剤では競合阻害と異なり、[S] 濃度を上昇させても酵素活性が回復することはありません。
反応速度論
この阻害剤では ES 複合体と結合して ESI 複合体を形成します(図7)。このとき解離定数 KI は以下の通りです。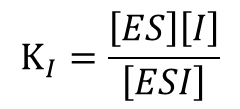
また、Michaelis-Menten の式は ・・・①
・・・①
この時 α’ は以下の通りです。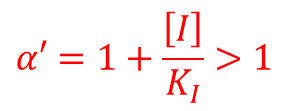 ・・・②
・・・②
この式を少し変形しましょう。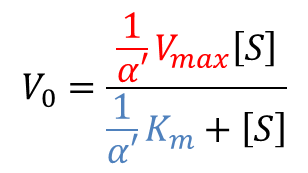
この時、1/α’ Vmax を見かけ上の Vmax(Vmaxapp)、1/α’ Km を見かけ上の Km(Kmapp)とみなすことができます。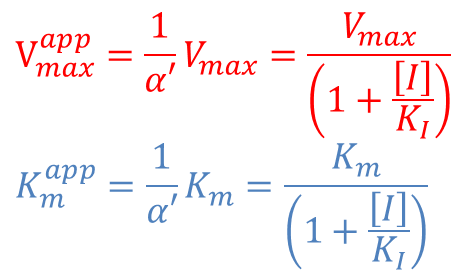
②の関係から 1/α’ < 1 なので、不競合阻害下では Kmapp や Vmaxapp は低下します。また、Vmaxapp が低下することから、[S] をいくら添加しても酵素活性が回復することはありません(図9)。
![不競合阻害ではLineweaver Burk プロットはY切片が [I] が増大するにしたがって増大する。ただし、傾きは一定である。](https://www.lifescience-note.net/wp-content/uploads/2025/02/image-77.png)
Lineweaver Burk プロットについてみていきましょう。まず、Lineweaver Burk プロットの式を確認します。Micaelis-Menten の式は以下の通りです。
両辺の逆数をとって整理すると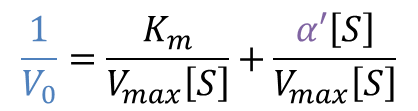

ここで、α’ は以下の通りなので、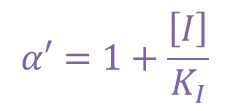
Lineweaver Burk プロットの式は以下の通り。
この結果から、Y 切片部分だけ抜き出すと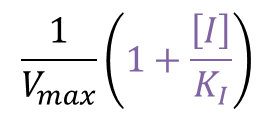
となっており、[I] の増大とともに大きくなる一方で、傾きは [I] とは無関係です。したがって、Lineweaver Burk プロットは [I] の増加に伴って Y 切片が大きくなる方向へ平行移動する(傾きは変わらない)ことがわかります。
非競合阻害剤
作用機序
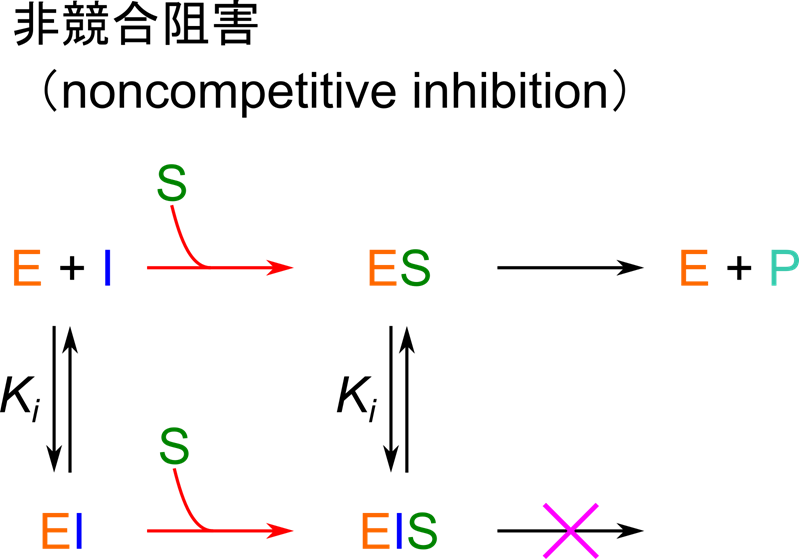
不競合阻害剤と名前が似ているので混同しないように気を付けてください。
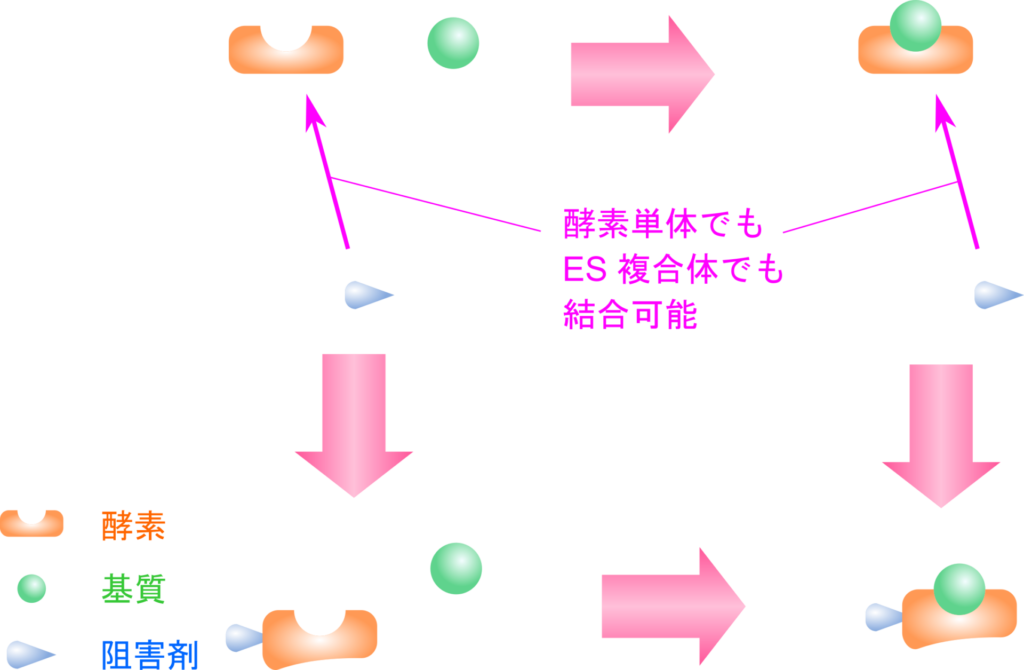
非競合阻害剤は酵素単体にも ES 複合体にも結合することができます。この阻害剤は活性部位とは異なる位置に結合して酵素の活性を阻害します。非競合阻害剤が酵素と結合すると酵素は機能を失います。その結果、非競合阻害剤の存在下では機能的な酵素濃度が低下することで阻害活性が発揮されます。この阻害剤は機能的な酵素が減少しますので、代謝回転数を低下させる能力があり、基質濃度を高めても酵素活性を回復させることはできません。
反応速度論
今回は簡単にするため、純粋な非競合阻害に限定して議論します。この阻害剤では酵素単体と結合し、EI 複合体を形成します。また、ES 複合体とも結合し、ESI 複合体を形成します。この時の酵素と阻害剤の結合や ES 複合体と阻害剤の結合は基本的には同等と考えることができるので解離定数はともに KI と置くことができます。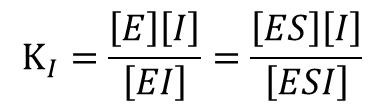
また、Micaelis-Menten の式は以下のようになります。 ・・・①
・・・①
ここで α は以下の通りです。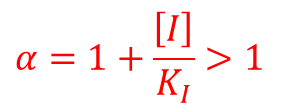 ・・・②
・・・②
①の式を少し変形します。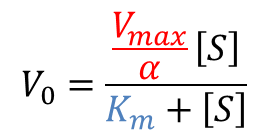
このことから、Vmax/α を見かけ上の Vmax(Vmaxapp)とみなすことができます。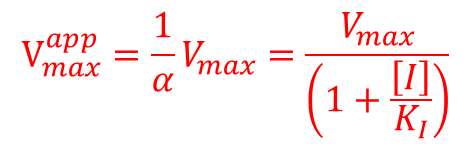
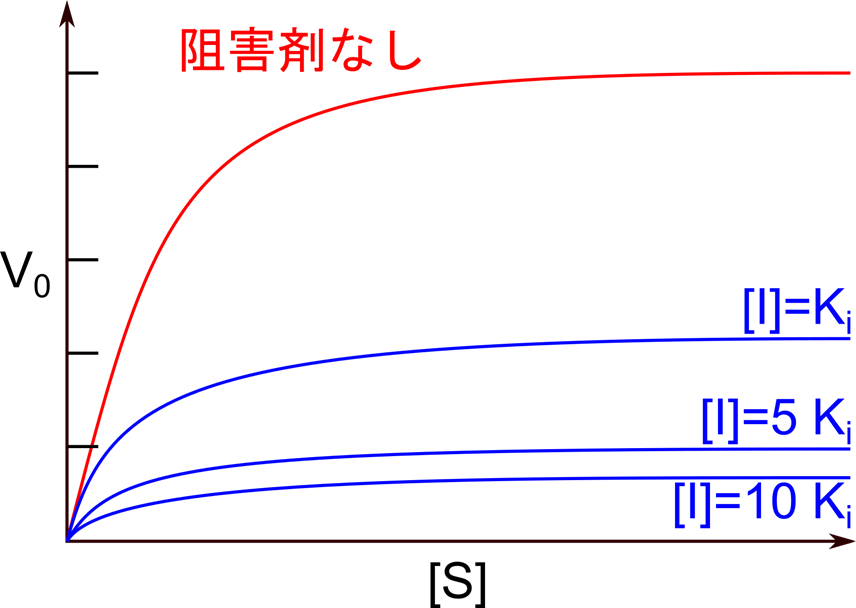
この時、Km は変化しませんが、α>1 なので、Vmaxapp は低下します。また、不競合阻害剤と同様、Vmaxapp が低下することから、[S] をいくら添加しても酵素活性が回復することはありません(図13)。
![非競合阻害ではLineweaver Burk プロットはX切片が変化しない一方で、傾きとY切片が [I] の増大に伴って増大する。](https://www.lifescience-note.net/wp-content/uploads/2025/02/image-80.png)
Lineweaver Burk プロットについてみていきましょう。まず、Lineweaver Burk プロットの式を確認します。Micaelis-Menten の式は以下の通りです。
この式を変形して、Lineweaver Burk プロットの式を導いてみましょう。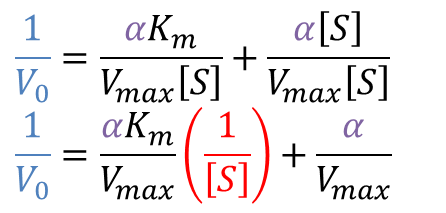
α は以下の通りなので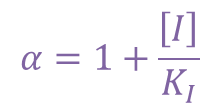
Lineweaver Burk プロットの式は以下の通り。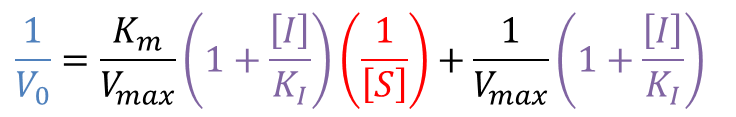
このことから、Y 切片と傾きは以下のようになります。
傾き :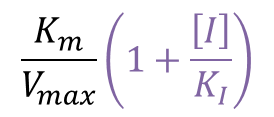
Y切片 :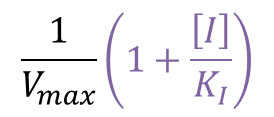
したがって [I] が増大するとともに増大していきます。一方で X 軸との交点を求めると、
となりますので、[I] と無関係な値となり、一定となります。したがって、[I] が増大するにしたがって、X 切片が一定で傾きが増大していきます。
不可逆阻害剤
不可逆阻害は可逆阻害剤とは異なり、共有結合を形成して不可逆的に結合して酵素反応を阻害します。
不可逆阻害には官能基特異的試薬(group-specific reagent)、反応性基質類似体(アフィニティーラベル; affinity label)、自殺基質(suicide substrate)などがあります。以下に概説していきます。
官能基特異的試薬
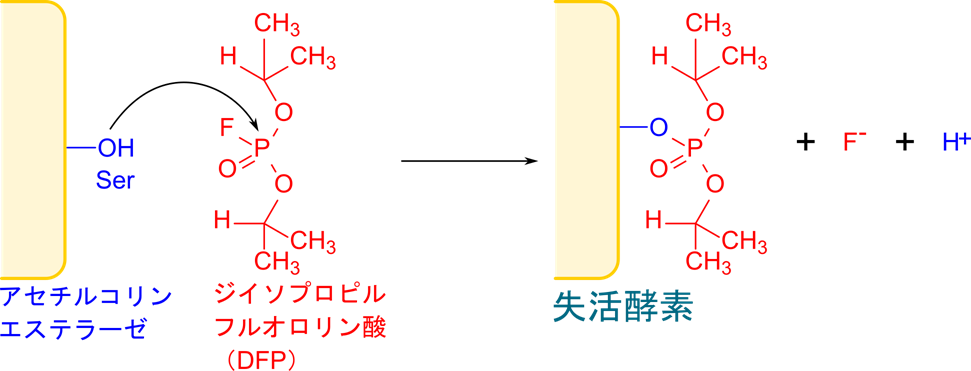
官能基特異的試薬の例としてジイソプロピルフルオロリン酸(diisopropyl fluorophosphate;DFP)があります。この阻害剤はキモトリプシンを阻害したり、神経伝達に重要なアセチルコリンエステラーゼを阻害する阻害剤です。この阻害剤ではキモトリプシンやアセチルコリンエステラーゼの活性に重要なセリン残基に結合してその機能を止めてしまうことで阻害します。このように、特定のアミノ酸残基の側鎖と共有結合を形成して結合し、阻害するものを官能基特異的試薬(group-specific regent)と呼びます。
反応性基質類似体(アフィニティーラベル)
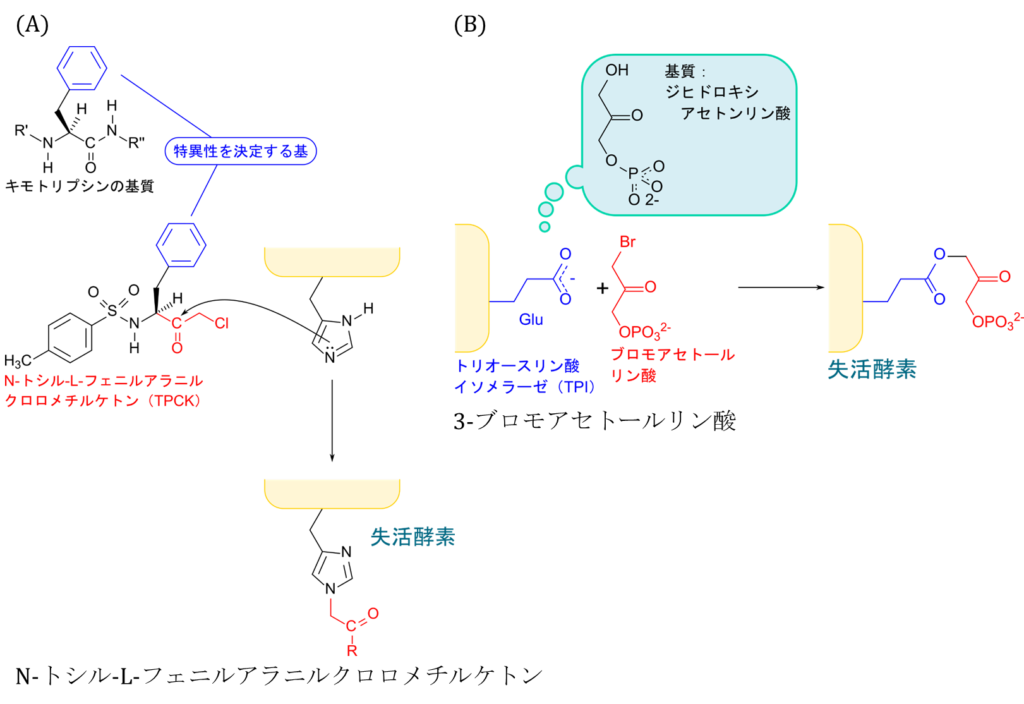
キモトリプシンは有名なプロテアーゼの一つですが、芳香族アミノ酸残基の C 末端を加水分解します。キモトリプシンの阻害剤である N-トシル-L-フェニルアラニルクロロメチルケトン(TPCK)はキモトリプシンの基質に類似した構造を持っており、キモトリプシンの活性部位に結合してヒスチジン残基を修飾します。この修飾は不可逆的であり、酵素活性を阻害します。他の例についても見てみましょう。トリオースリン酸イソメラーゼはジヒドロキシアセトンリン酸をグリセルアルデヒド-3-リン酸に転換する酵素です。3-ブロモアセトールリン酸はトリオースリン酸イソメラーゼの阻害剤ですが、グリセルアルデヒド-3-リン酸と類似した構造を持っています。この物質はトリオースリン酸イソメラーゼのグルタミン酸残基と共有結合して酵素活性を阻害します。このように、基質と類似した構造を有し、活性部位にあるアミノ酸残基を不可逆的に修飾して酵素活性を阻害する阻害剤を反応性基質類似体(reactive substrate analog; アフィニティーラベル; affinity label)といいます。
自殺基質
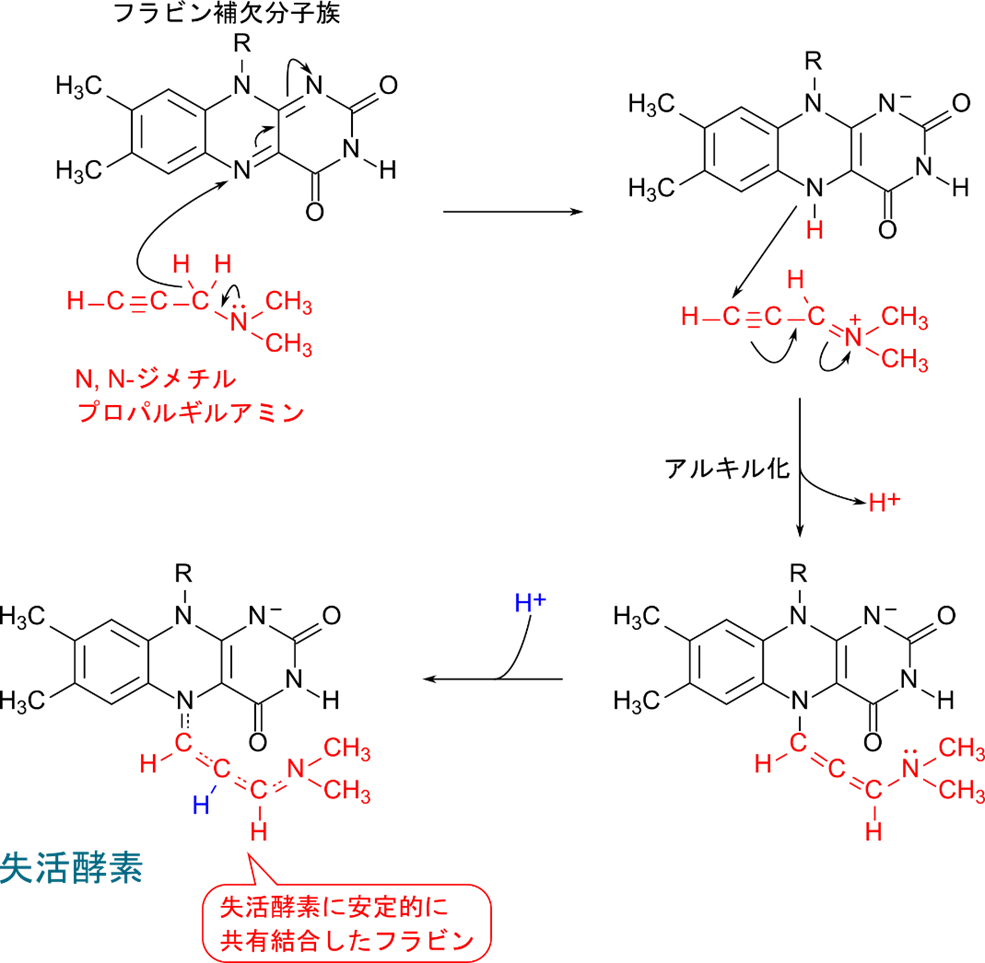
N, N-ジメチルプロパルギルアミンはモノアミンオキシダーゼの阻害剤として知られています。モノアミンオキシダーゼはある種の神経伝達物質を酸化する酵素ですが、この反応には FAD を要求します。N, N-ジメチルプロパルギルアミンは FAD による酸化を受けて活性化されると、フラビン補欠分子族(FAD の一部)をアルキル化して酵素を失活させます。このように、阻害剤自体が基質として酵素の作用を受け、産生された反応中間体が酵素に共有結合することで酵素活性を阻害するものを自殺基質(suicide substrate)といいます。
今回は酵素の阻害剤について概説してきました。酵素阻害剤は、医療、農業、バイオテクノロジーなど幅広い分野で活用され、私たちの生活に大きな影響を与えています。酵素阻害のメカニズムを知ることは、生命科学の重要な鍵のひとつ。これを機に、酵素阻害剤に興味を持ってみてはいかがでしょうか?