酵素が機能する上で重要となる部位が活性部位です。活性部位は結合に関与するアミノ酸残基や触媒作用を発揮するアミノ酸残基が集中していたり、触媒作用に必須な因子が結合しているなど、酵素の機能の根本にかかわっています。今回は活性部位の特徴を中心に、酵素の活性を支える補助因子についても解説します。
Contents
活性中心の特性について
酵素が機能を果たすうえで重要な部位が活性部位(active site) です。酵素はこの活性部位を介して基質と結合し、基質-酵素複合体(substrate-enzyme complex;ES複合体) を形成しますが、ES複合体の形成によって、活性化エネルギーが低下し、反応が促進されるとともに、基質特異的な反応が引き起こされます。
活性部位には、反応に関与するアミノ酸残基が含まれており、これを触媒基(catalytic group) と呼びます。触媒基が活性部位に存在することで、酵素は基質に適切にアプローチすることができます。このように、活性部位は酵素の機能において重要な役割を担っており、いくつかの共通した特徴を持っています。
活性部位の形状と基質の認識
活性部位はポケット状の構造をとっており、基質がはまり込むようにして結合します。そのため、結合に関与するアミノ酸残基は活性部位に集中しています。これらのアミノ酸残基は折りたたみ構造などによって立体的に近くに配置されています。なお、一次構造上では離れている場合が多いので注意が必要です。
シトクロム P450 を例に見てみましょう(図1)。シトクロム P450 はショウノウのような有機化合物に酸素を付加します。この酵素の活性部位にはヘムのように酵素の機能に重要な因子が結合しており、他にもショウノウ(基質)との結合に必要なアミノ酸残基(図4の右側)が集中しており、ショウノウはシトクロム P450 と結合して ES 複合体の形成が可能になります。なお、アミノ酸残基に並記した番号はアミノ酸配列上の各残基の位置を表していますが、この数値がとびとびなことから一次構造上は離れていることがわかります。
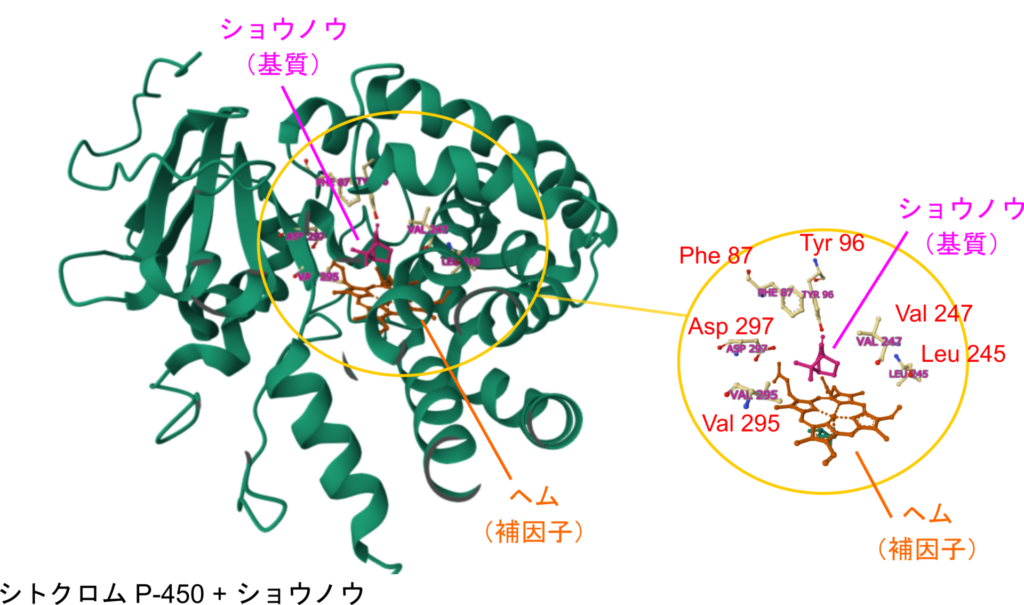
シトクロム P450 とショウノウにより構成される ES 複合体(左側)と基質との結合に関与するアミノ酸残基、触媒基、補因子とショウノウの位置関係(右側)左側にはシトクロム P450 がショウノウと ES 複合体を形成した際の構造を示しています。右側には基との結合や活性に関与するアミノ酸残基と補因子を、配置を維持したまま抜き出して示しています。右の図では、ショウノウがポケット状の活性部位にはまり込んでいることがわかります。また、左の図で、重要なアミノ酸残基はショウノウを取り囲むように配置されてショウノウと結合を形成できたり、機能を発揮できるようになっています。
基質特異性と結合に関与する力
活性部位の内部は外部とは異なる環境を形成おり、このような活性部位には、水ですら(反応に関与する場合を除いて)入り込みません。活性部位の大部分は無極性を呈していて、その中で基質との結合に関与するアミノ酸残基は極性を持っています。基質との相互作用に関与する結合は以下のような非共有性結合が担っています。
- 静電的相互作用(例えばイオン結合)
- 水素結合
- ファンデルワールス力
- 疎水結合
これらの結合が形成されると安定化するため、余剰のエネルギー(結合エネルギー;binding energy)が放出されます。このエネルギーは活性化エネルギーを低下させるために利用されます。
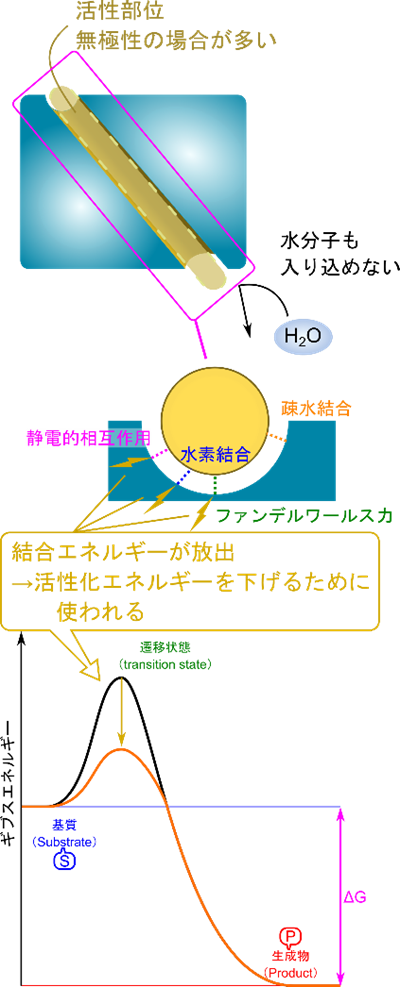
酵素による基質の認識
結合を形成する原子の配置は、基質特異性を生み出す要因となります。基質と酵素の結合に関与する非共有結合は、関与する原子同士が近接することで初めて形成されます。そのため、基質の結合に関与する原子配置にぴったり一致するように酵素の原子が配置されていると、形成される結合数が最大化され、基質と酵素が効率的に結合できます。この原子の配置こそが基質特異性を生み出す要因となるのです。
この基質特異性を説明するモデルとして、Emil Fischer によって提唱された「鍵と鍵穴モデル」 があります。このモデルでは、基質と酵素がちょうど鍵と鍵穴のようにぴったりフィットする(相補的である)ことで基質特異性が生じると考えられています。このモデルでは、基質が結合するかどうかにかかわらず、酵素の形は変化しないという前提が置かれています。
しかし近年では、酵素は柔軟な構造を持ち、基質と結合する際に形を変えて基質とフィットするようになると考えられています。この性質を誘導適合(induced fit) といい、この考えに基づくモデルは「誘導適合モデル」と呼ばれています。
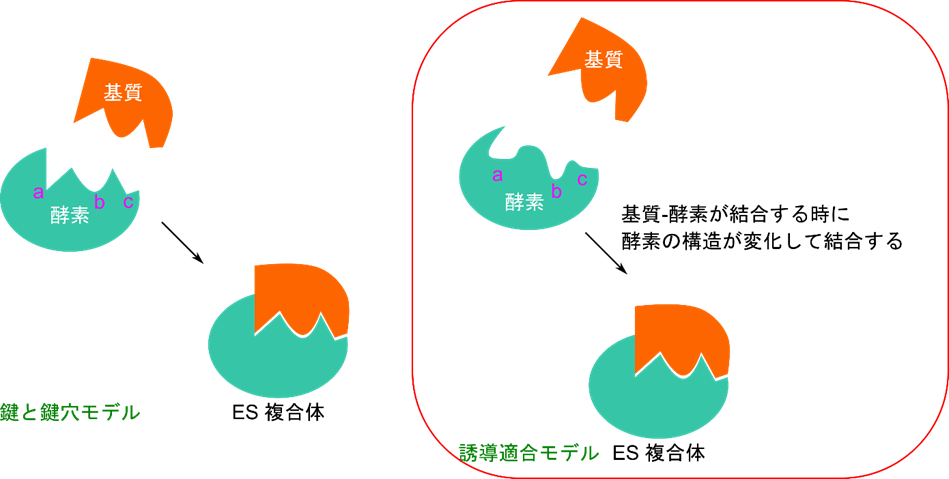
酵素は立体構造を見分けることができる
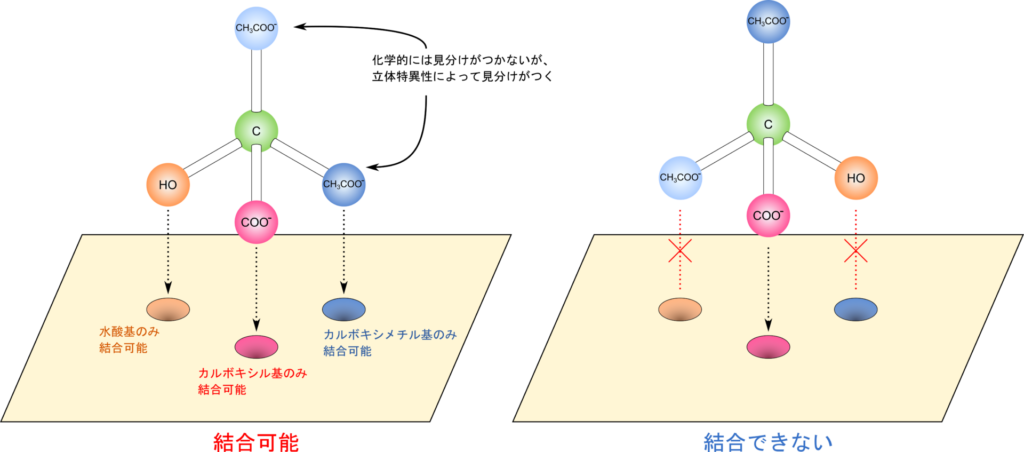
例として、アコニターゼ を見てみましょう。この酵素はクエン酸 に作用し、イソクエン酸 に変換します。この反応は、水酸基をカルボキシメチル基(CH₂COOH) に転位させるものです。
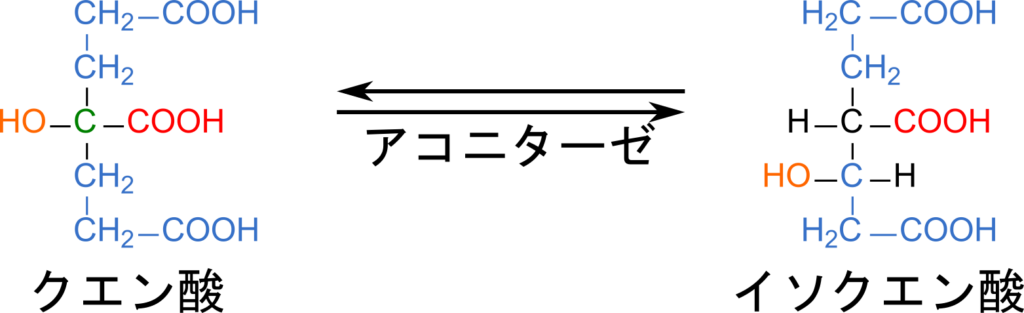
クエン酸には立体異性体が存在しません。一方でどちらのカルボキシメチル基に水酸基が転位されるかによって、生成物にはいくつかの立体異性体が生成する可能性があります。ところが実際には決まった立体異性体しか生成されません。これはアコニターゼがクエン酸の立体構造を見分けていることを意味しています。
アコニターゼは水酸基、カルボキシル基、カルボキシメチル基を見分けて結合します。この時各置換基が結合する部位は決まっているため、基質が結合する方向は常に決まった方向となります。その結果、化学的には見分けがつかないはずのカルボキシメチル基は常に同じ配置につくことになり、水酸基が転位される置換基が決まってきます。このように、基質の置換基と酵素が相互作用する部位の配置が決まっていることにより、基質が結合する方向が決まります。このような認識の仕方が酵素の立体特異性を生み出す要因となります。
酵素の機能に必須な補助因子
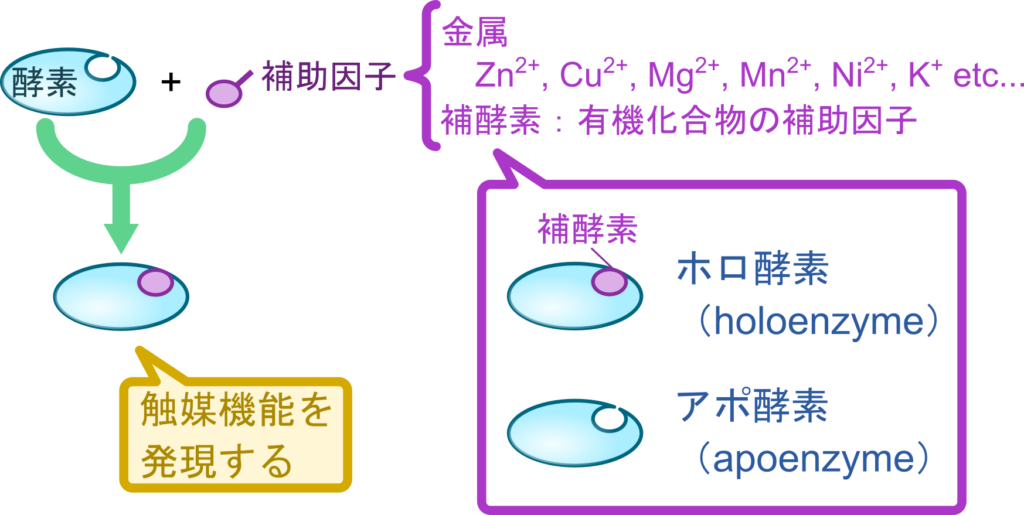
酵素の中にはタンパク質だけでなく、金属やタンパク質でない有機化合物のような非タンパク質部分を含むものがあります。このようなタンパク質はこの非タンパク質部分によってはじめて触媒機能を発揮できるものが多くあります。これらの非タンパク質部分は活性部位と相互作用しているものも多くあります。酵素が触媒機能を発揮する際に必要となる非タンパク質部分を補助因子(cofactor)といいます。補助因子には亜鉛、銅、マグネシウムのような金属イオンや、NADH、FADH2、ヘム、ビタミン類のような有機化合物が含まれています。補助因子の内、有機化合物のものを補酵素(coenzyme)といいます。補酵素を要求する酵素の場合、補酵素以外のタンパク質部分をアポ酵素(apoenzyme)、アポ酵素と補酵素が結合した複合体をホロ酵素(holoenzyme)といいます。
- 補酵素 :有機化合物の補助因子
- アポ酵素:補酵素以外のタンパク質部分
- ホロ酵素:補酵素+アポ酵素
補酵素には酵素に強く結合するものと弱く結合するものがあります。補酵素の内、タンパク質部分との結合が強く解離しにくい場合は補欠分子族(prosthetic group)といい、補欠分子族の多くは共有結合している場合が多いです。シトクロムは補欠分子族であるヘムを持ちますが、疎水結合や水素結合、共有結合などによって強固に結びついています。
一方で結合の弱いものは基質が酵素と相互作用できるように、結合したり離れたりすることが可能です。補酵素の一部には再生が必要なものがあります。このような補酵素は別の酵素の機能によって元の状態に再生されます。例えば、NAD+ は代表的な補酵素の一つですが、還元型では NADH となり、酸化されると NAD+ に変換されます。解糖系や TCA サイクルで消費された NAD+ は電子伝達系で再生されて NADH に変換されます。すると再び利用可能になります。こうすることで限られた量の NAD+ を効率よく利用することができます。NAD+ を要する反応と再生する反応は異なる場所で、異なる酵素が関与するので補酵素が解離できた方が都合がいいです。弱い相互作用で結合する補酵素はこのような場面で有利になります。
前回の記事では酵素の全般的な特徴について解説しました。今回の内容はそこからもう一歩踏み込んで、酵素の中でも最も重要な機能を持つ活性部位と、酵素活性に深く関与する補助因子について解説しました。これらの議論は酵素の機能を考える上で最も大切な概念ですので、ぜひ理解を深めてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 92-122
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.198-262
- D. Voet, J. G. Voet, C. W. Pratt著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017). ヴォート 基礎生化学 第5版. 東京化学同人. pp. 216-241