アミノ酸の生合成は「アミノ基の導入」と「炭素骨格の供給」に大別されます(詳細はこちら)。本記事ではその中でも重要なアミノ基導入に注目し、グルタミン酸・グルタミンの生成経路、アミノ基転位反応、さらにアスパラギンの合成までを解説。アミノ酸代謝の理解を深めるための基礎として、ぜひ参考にしてください。
アンモニウム塩の取り込み
アミノ基は 2-オキソグルタル酸にアンモニアが付加してグルタミン酸が生成されることで固定されます。この反応はグルタミンデヒドロゲナーゼ(glutamate dehydrogenase)によって触媒されます。2-オキソグルタル酸はグルタミン酸と非常に類似した構造をしており、グルタミン酸の α 炭素がカルボニル基(C=O)になった構造をしています。ここに、アンモニアが付加するとカルボニル基(C=O)がイミノ基(NH2=C)に変換されます。この分子はイミノ基を含むのでイミンと呼ばれます。また、この中間体はシッフ塩基であり、容易に還元されて水素化(水素付加)を受けます。その結果、イミノ基はアミノ基(NH3-C)に変換され、グルタミン酸となります。この反応は植物や微生物では窒素を取り込むとても重要な反応であり、生成されたグルタミン酸は各種アミノ酸に対してアミノ基を供給する供給源となります。
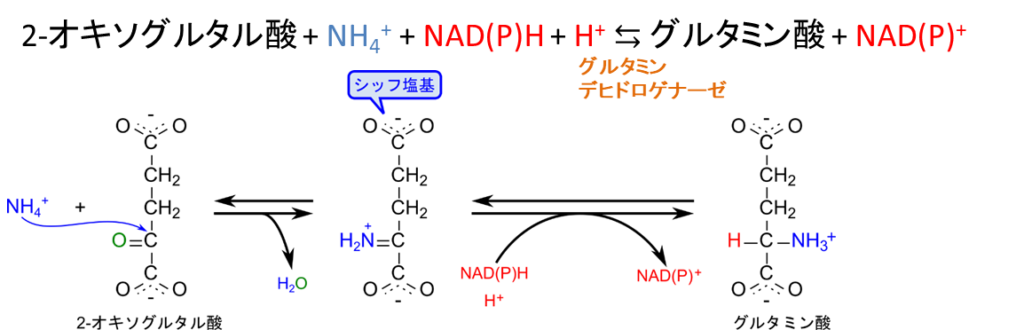
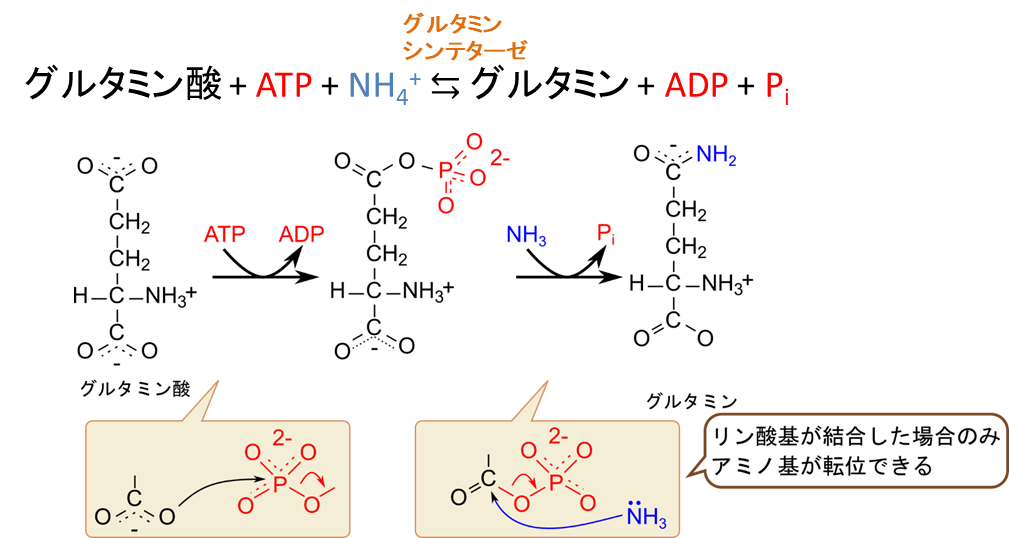
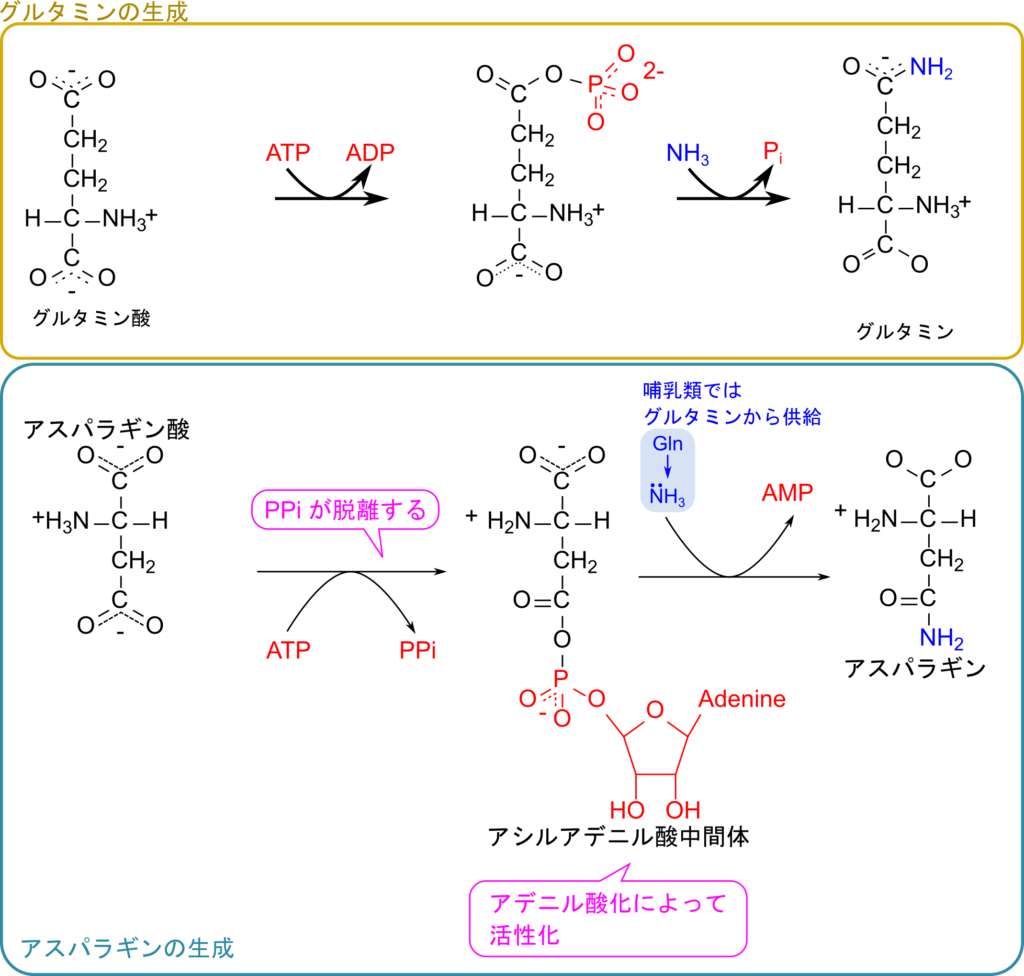
次に、グルタミンの生合成についてみていきましょう。この反応ではグルタミン酸が ATP を消費してリン酸化されます。このリン酸基の影響により、カルボキシル基の炭素にアンモニアが付加しやすくなり、リン酸基と交換でアミノ基が付加します。この反応はグルタミンシンテターゼ(Glutamine synthetase)が触媒します。この反応でもアンモニアを取り込むことができ、グルタミンもアミノ酸へのアミノ基の供給源となります。
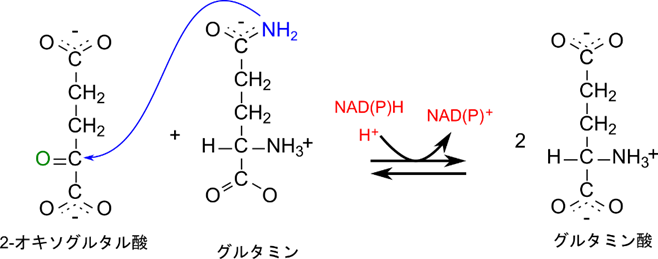
ところで、原核生物は以下のようなグルタミン酸の合成経路も持っています。この経路ではアミノ供与体がアンモニアではなくグルタミン酸が利用されています。グルタミンのアミノ基が 2-オキソグルタル酸のカルボニル基に転位することで(2-オキソグルタル酸+アミノ基で生成されるグルタミン酸とグルタミンからアミノ基が転位することで生じるグルタミン酸)グルタミン酸が 2 分子合成されます。この反応はグルタミンシンターゼ(glutamate synthase)によって触媒されます。グルタミンシンテターゼとは違う酵素なので注意してください。
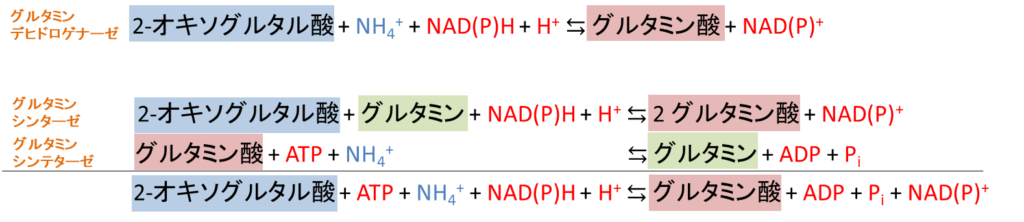
グルタミンシンターゼの反応はグルタミンシンテターゼの反応と合わせて考えると、2-オキソグルタル酸とアンモニアによりグルタミン酸が生成する反応となります。ただし、この経路ではグルタミンデヒドロゲナーゼと異なり、ATP を一つ消費してしまいます(図4)。一見すると効率が悪いように見えますが、この経路にはどういった利点があるのでしょうか?この違いのカギはグルタミンデヒドロゲナーゼとグルタミンシンテターゼの違いにあります。
- グルタミンデヒドロゲナーゼ:Km 値が比較的高い→低 NH3 濃度の時に機能しにくい
- グルタミンシンテターゼ:親和性が高い→低 NH3 濃度の時にも機能できる
グルタミンデヒドロゲナーゼは効率がいいのですが、高 Km 値のためアンモニアと親和性が低く、アンモニア濃度が低い場合には機能しにくくなります。一方で、グルタミンシンテターゼではアンモニアとの親和性が高く低アンモニア濃度下でも十分に機能することができます。このため ATP の消費を伴ったとしても状況によってはグルタミンシンターゼ+グルタミンシンテターゼの経路を利用する利点があるのです。
アミノ基転位反応
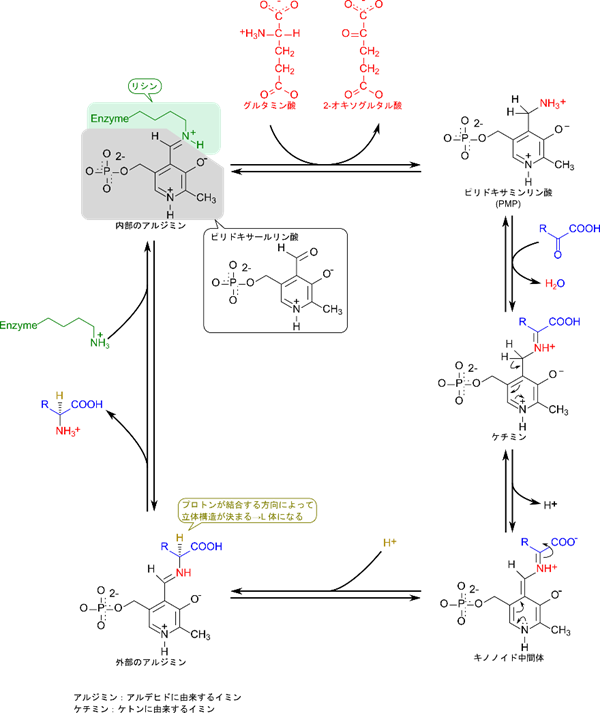
グルタミン酸やグルタミン以外のアミノ酸は各種 2-オキソ酸にアミノ基が転位することで生成されます。この反応は各種のアミノトランスフェラーゼによって触媒されます。どのように触媒されるのか見ていきましょう。
この反応でカギとなるのは補酵素であるピリドキサールリン酸(PLP; pyridoxal phosphate)です。PLP のホルミル基(-CHO)と酵素のリシン残基の側鎖アミノ基がイミン基を形成し結合しています(このようにアルデヒド(aldehyde)に由来するイミン(imine)のことをアルジミン(aldimine)といいます)。このアルジミンは酵素の内部にあるため内部のアルジミンと呼ばれます。内部のアルジミンはいくつかの反応を経由してグルタミン酸からアミノ基を受け取ります。アミノ基を渡したグルタミン酸は 2-オキソグルタル酸に変換されます。一方で、アミノ基を受け取ったことにより内部のアルジミンはピリドキサミンリン酸(PMP)に変換されます。次いで、2-オキソ酸のカルボニル基(C=O)と反応してケチミンを形成します(このようなケトン(ketone)に由来するイミン(imine)のことをケチミン(ketimine)といいます)。その後水素が失われてキノノイド中間体(キノン※に似た構造を持つ中間体)を生成し、別な位置に水素が付加すると外部のアルジミンが生成されます。このステップはアミノ酸の立体構造を決める重要な工程です。この時、水素は画面から見て後ろ側から付加することで、生成されるアミノ酸が L 体となることが運命づけられます。最後にアミノ酸部分が放出されると目的のアミノ酸が生成されました。さらに酵素のリシン残基が結合すると、内部に移行して内部のアルジミンとなります。こうしてアミノトランスフェラーゼは元通りとなりました。
アスパラギンの生成
アスパラギン酸にアミノ基が転位されるとアスパラギンが生成されます。この反応はグルタミンの生成と化学的には類似しています。互いに比較しながら反応過程を見ていきましょう。どちらの反応もATP を消費して進行する反応ですが、グルタミンと異なり、アスパラギンの生成ではリン酸化されるのではなく AMP が結合します。したがって二段階目ではリン酸ではなく AMP が遊離してアミノ基が付加されます。もう一つの相違点はアミノ基の供与体がアンモニアかグルタミンかの違いです。グルタミンではアンモニアからアミノ基が供給されるのでアミノ基の取り込みだったり、無毒化という側面がありますが、アスパラギンの生成ではグルタミンから供給されるのでこのような意味合いはありません。
今回は、アミノ酸生合成の中でも「アミノ基の導入」に焦点を当てて解説してきました。アミノ基の導入は、炭素や水素、酸素などが広く利用される生体内の反応とは異なり、窒素という特殊な元素を扱う、非常に特徴的な経路です。このように、限られた分子だけが取り扱う窒素の導入やアミノ化のプロセスは、他の反応とは一線を画すユニークな生合成反応といえるでしょう。
こうした反応の個性や共通点をしっかりと捉えることで、複雑に見えるアミノ酸の生合成も、整理された知識として理解できるようになります。この記事が、その手助けになれば幸いです。ぜひもう一度記事を読み返して、アミノ酸生合成の面白さと奥深さを実感してみてください。
参考資料
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 208-223
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.665-693
- D. Voet, J. G. Voet, C. W. Pratt 著、田宮信雄、八木達彦、遠藤斗志也、吉久徹訳 (2017) ボート 基礎生化学 第5版. 東京化学同人. pp.496-503
- KEGG PATHWAY DATABASE. 2025-03-03. https://www.genome.jp/kegg/pathway.html