酸と塩基は化学反応の反応機序を議論するときに非常によく出てくる重要な概念の一つです。酸と塩基の定義にはアレニウスの定義、ブレンステッドローリーの定義、ルイスの定義と三つも定義が存在します。そこでこの記事では様々な酸・塩基の定義をわかりやすく解説していこうと思います。
Contents
アレニウスの酸・塩基
アレニウス(Arrhenius)の定義によると、水に溶解させたときプロトンを放出する物質を酸、水酸化物イオンを放出する物質をアルカリ(塩基)といいます。なお、アルカリは水に溶解した塩基のことを言います。それぞれの例を見てみましょう。
- 酸 :HCl → H+ + Cl–
- 塩基:NaOH → Na+ + OH–
ブレンステッド-ローリーの酸・塩基
アレニウスの定義を拡張してみましょう
アレニウスの定義では水に溶解した状態でしか定義することができません。ところが、酸と塩基の反応は気体や個体の状態でも発生します。このような場合はアレニウスの定義では対応できません。そこで、アレニウスの定義の拡張が必要になります。
ブレンステッド-ローリー(Brønsted-Lowry)の定義によると
- プロトンを放出する分子を酸(acid)
- プロトンを受け取る分子を塩基(base)
と考えられます。この定義では酸と塩基の間で行われるプロトンのやり取りに注目して定義しています。この定義はアレニウスの定義のように水に溶解させているかは関係がありません。ところでこの定義はアレニウスの定義の拡張ですから、アレニウスの定義と矛盾してはいけません。少しチェックしてみましょう。以下の反応についてみてみます。
HCl + H2O ⇆ Cl– + H3O+
この例では HCl がプロトンを放出しているので酸、H2O がプロトンを受け取っているので塩基となります。アレニウスの定義と同様に HCl を水に溶かした場合、HCl が酸と定義できました。次の例を見てみます。
NH3 + H2O ⇆ NH4+ + OH–
この例では H2O がプロトンを放出しているので酸、NH3 がプロトンを受け取っているので塩基と定義されます。アレニウスの定義でも NH3 は塩基と定義されますが、同様に塩基と定義できました。次の例を見てみます。
NaOH + H3O+ ⇆ Na+ + 2H2O
この例は一見、NaOH がプロトンを受け取っていないように見えますが、
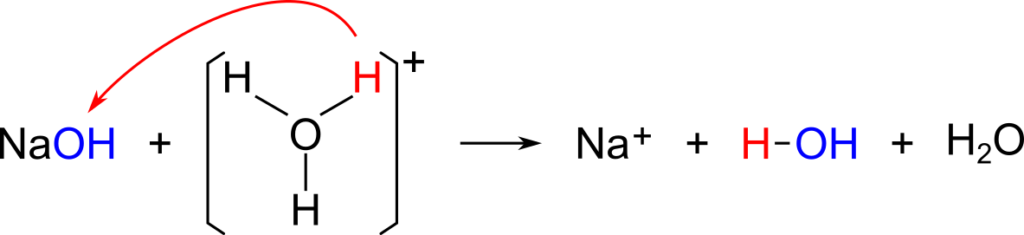
のように見ることで、H3O+ がプロトンを放出しているので酸、NaOH の OH– 部分がプロトンを受け取っているので塩基と定義できます。この例でもアレニウスの定義と同様に NaOH を塩基と定義できました。
このように、プロトンのやり取りに注目することでうまく拡張することができました。このことから ブレンステッド-ローリーの定義がアレニウスの定義の拡張であることが納得できたのではないでしょうか。
ブレンステッド-ローリーの酸・塩基と共役酸・共役塩基とは?
ここでは、ブレンステッド-ローリーの酸・塩基にかかわる用語を確認していきましょう。以下の例を見てみます。
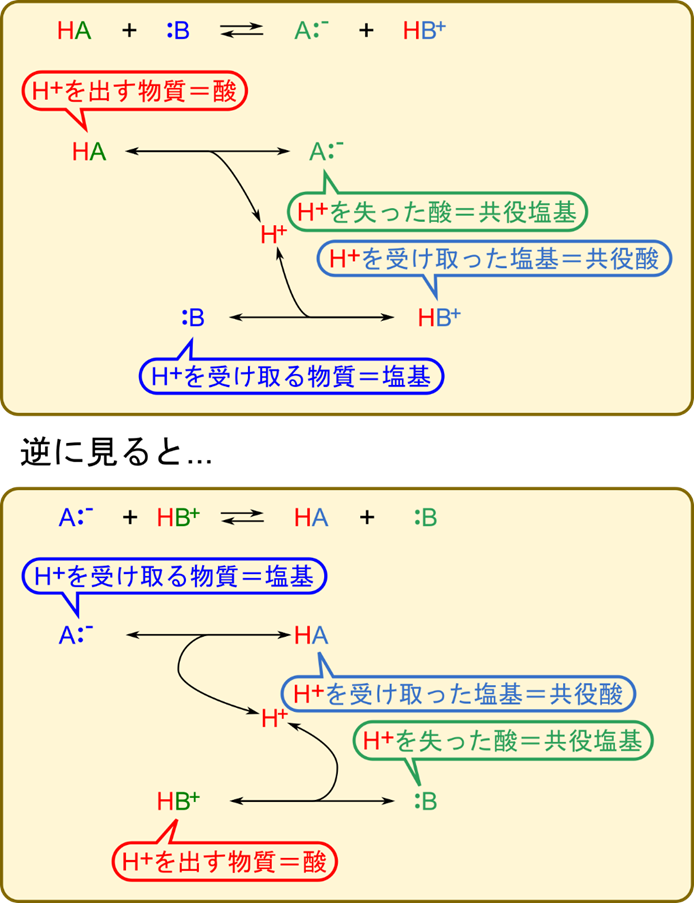
HA + B ⇆ A– + HB+
この反応で
- HA はプロトン(H+)を放出して A– となる:HA は酸(acid)
- B はプロトンを受けって HB+ となる :B は塩基(base)
さらに、
- 酸(HA)がプロトンを放出して産生される A– :共役塩基(conjugated base)
- 酸から産生されるのが共役塩基となる
- 逆の反応を考えると、A– はプロトンを受け取って HA を産生するので塩基と覚えましょう
- 塩基(B)がプロトンを受け取って産生される HB+ :共役酸(conjugated acid)
- 塩基から産生されるのは共役酸
- 逆の反応を考えると、HB+ はプロトンを放出して B を産生するので酸と覚えましょう
次にこの反応を逆から見てみましょう。
A– + HB+ ⇆ HA + B
この反応では
- HB+ がプロトンを放出して B となる :HB+ は酸
- A– はプロトンを受け取って HA となる:A– は塩基
この場合
- HB+ がプロトンを放出して産生される B :共役塩基
- A– がプロトンを受け取って産生される HA:共役酸
となります。このように、ブレンステッド-ローリーの定義ではプロトンのやり取りに注目して酸か塩基かを決定します(図1)。
実際の例を見てみましょう。以下の反応について考えます。
CH3COOH + H2O ⇆ CH3COO– + H3O+
この場合、
- 酢酸(CH3COOH)はプロトンを放出:酸
- H2O はプロトンを受け取る :塩基
さらに
- 酢酸(CH3COOH)に対して酢酸イオン(CH3COO–)は共役塩基
- H2O に対して H3O+ は共役酸
一方で逆の反応を考えると、
CH3COO– + H3O+ ⇆ CH3COOH + H2O
なので、
- 酢酸イオン(CH3COO–)はプロトンを受け取る:塩基
- H3O+ はプロトンを放出 :酸
さらに
- 酢酸イオン(CH3COO–)に対して酢酸(CH3COOH)は共役酸
- H3O+ に対して H2O は共役塩基
となります。この例でもわかるように、ブレンステッドローリーの定義では物質によって酸と塩基を定義するわけではありません。酢酸イオンと言っても酸となるわけではなく、塩基となる場合もあるので注意してください。もう一つ例を見てみましょう。
NH3 + H2O ⇆ NH4+ + OH–
この例では
- NH3 はプロトンを受け取る:塩基
- H2O はプロトンを放出 :酸
さらに
- NH3 に対して NH4+ は共役酸
- H2O に対して OH– は共役塩基
となります。酢酸の例では H2O は塩基でしたが、この例では酸です。同じ物質でも反応によって酸にも塩基にもなるので注意してください。
酸の強さの評価
ブレンステッド-ローリーの定義に従うと考えた場合、酸の強さを一義的に表現することが可能です。以下の例を考えてみます。
HA + H2O ⇆ A– + H3O+
この例は酸 HA を水に溶解させた場合の反応です。この反応の平衡を考えます。平衡定数は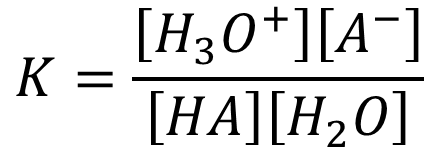
となります。水 H2O は大量に存在していてほぼ変化しないと考えられます。そこで [H2O] は一定とみなして、K [H2O] を定数 Ka と置きなおします。
Ka=K [H2O]
この Ka は酸解離定数と呼ばれ、酸の強さの指標として使用されます。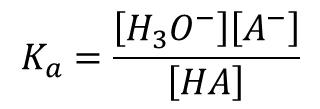
※[ ] はモル濃度 (mol//L) を表します
Ka の値は極めて幅広い値を持っていて、最も強いものでは約 1015、有機酸では通常 10-5 ~ 10-15 の範囲の Ka を持っています。このままでは値が大きくなりすぎて扱いにくいので、通常、酸の強さを評価する場合は pKa を利用します。![]()
表1に pKa の例を示しています。強い酸ほどプロトンを放出しやすく、弱い酸ほどプロトンを放出しにくいという関係になります。pKa と酸の強さ、塩基の強さの関係は以下の通りです(表1)。
- 大きい pKa:弱い酸 強い塩基
- 小さい pKa:強い酸 弱い塩基
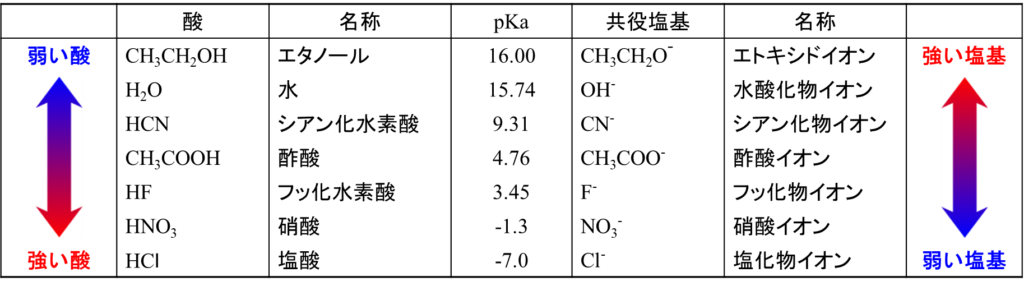
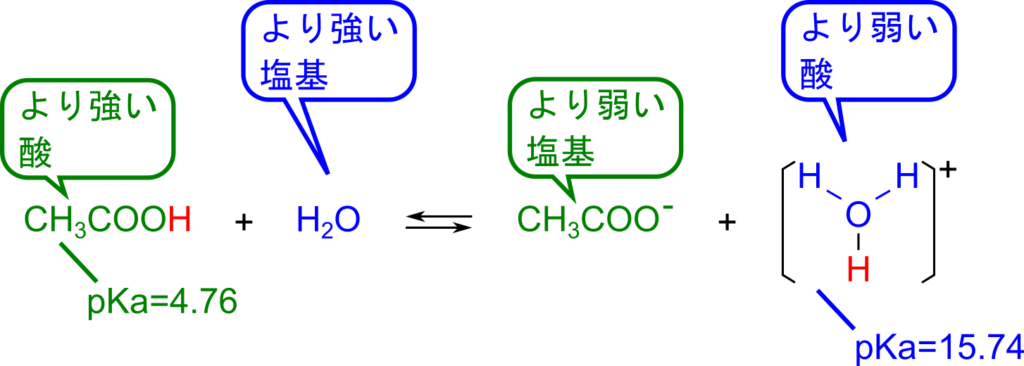
pKa を見ることによって反応の進みやすさを判断することができます。酢酸を水に溶解させた場合を考えてみます。酢酸の pKa は 4.76 で、水の pKa は15.74 です(表1)。したがって、
- 酢酸は H3O+よりも強い酸(pKa が小さいほうが強い酸)
→ 酢酸は H3O+ よりプロトンを放出しやすい - 水は酢酸イオンよりも強い塩基 (pKa が大きいほうが強い塩基)
→ 水は酢酸イオンよりプロトンを受け取りやすい
となりますので、この反応は進みやすいことがわかります。反応性が高い場合を一般化すると以下の通りです。
- 反応前の酸(上の例では CH3COOH)は反応後の酸(上の例では H3O+)よりも強い
- 反応前の塩基(上の例では H2O)は反応後の塩基(上の例では CH3COO–)より強い
このように反応前の酸と塩基が反応後の酸と塩基より強い場合に反応は進むとわかります。
ルイスの酸・塩基
酸・塩基の定義のさらなる拡張
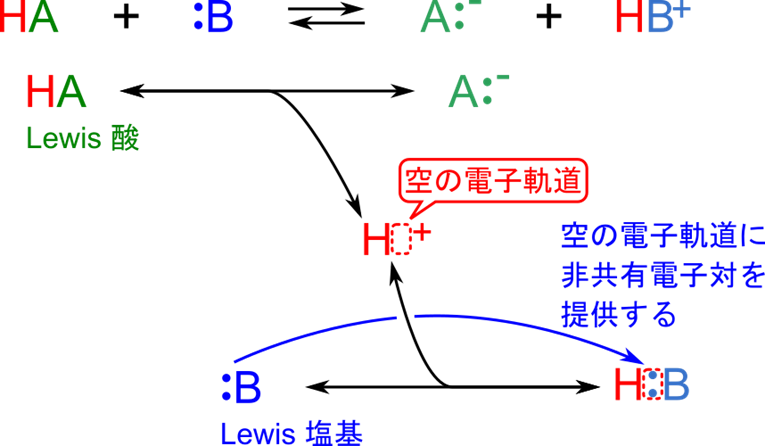
前項のブレンステッド-ローリーの定義について確認してきました。この定義でも酸と塩基の定義は十分拡張できたように思われますが、もう少し拡張してみようと思います。図2を見てください。この反応では酸 HA がプロトンを放出して塩基 B が受け取る反応です。ここでプロトンには空の電子軌道があります。一方で塩基である B には非共有電子対が存在しています。HB+ が生成する反応は B が持つ非共有電子対をプロトンの空の電子軌道に入れて結合を形成しています。この電子対のやり取りに注目すると新たな定義ができそうです。この定義こそがルイス酸・塩基の定義であり、具体的には以下の通りです。
ルイス(Lewis)の定義によると
- ルイス酸 :電子対を受け取る物質
- ルイス塩基:電子対を供与する物質
この定義に従うと、図2の例では HA が ルイス酸で B がルイス塩基です。なお、ルイス酸のことをルイス試薬と表現することもあります。
この内容で酸と塩基が説明できることを確認してみましょう。まずは HCl を水に溶解させた場合です。
- プロトン(HCl が放出)が電子を受け取る → HCl はルイス酸
- H2O は電子対をプロトンに供与する → H2O はルイス塩基
と判断で来て、HCl が酸と判断できました。HCl はブレンステッドローリーの定義やアレニウスの定義でも酸と定義されていましたね。

次は NH3 を水に溶解させた場合です。
- プロトン(H2O が放出)が電子を受け取る → H2O はルイス酸
- NH3 は電子対をプロトンに供与する → NH3 はルイス塩基
と判断で来て、NH3 が塩基と判断できました。これもブレンステッドローリーの定義やアレニウスの定義と一致しています。
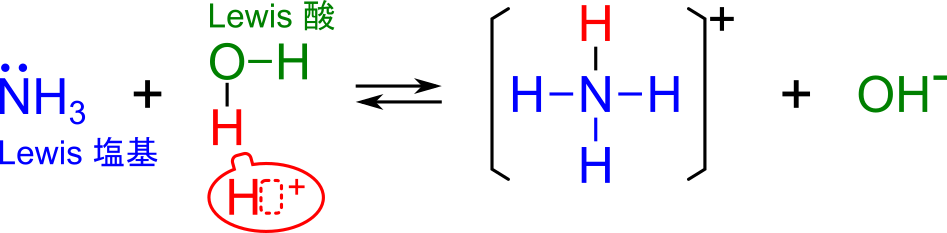
次は NaOH を水に溶解させた場合です。
- プロトン(H3O+ が放出)が電子を受け取る → H3O+ はルイス酸
- OH–(NaOH が放出)は電子対をプロトンに供与する → NaOH はルイス塩基
と判断で来て、NaOH が塩基と判断できました。これもブレンステッドローリーの定義やアレニウスの定義と一致しています。
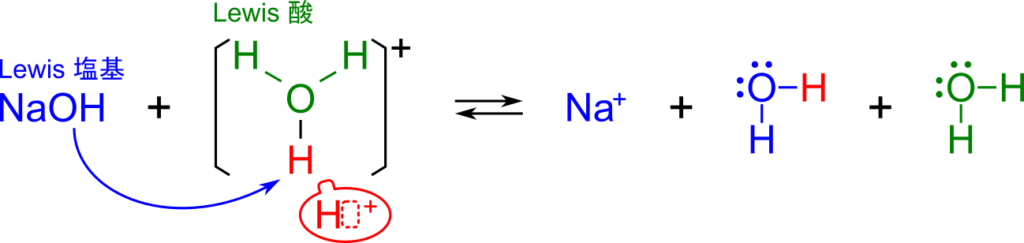
このようにこれまでの定義と同様の結果が得られました。さらに、ルイスの定義では電子対のやり取りを元に定義しますので、プロトンのやり取りに縛られず様々な反応でも酸・塩基を定義できます。
以下の反応は三塩化アルミニウムとトリメチルアミンが錯体を形成する反応です。この反応では
- 三塩化アルミニウムのアルミニウムが電子を受け取る → 三塩化アルミニウムはルイス酸
- トリメチルアミンの窒素が電子対を供与する → トリメチルアミン はルイス塩基
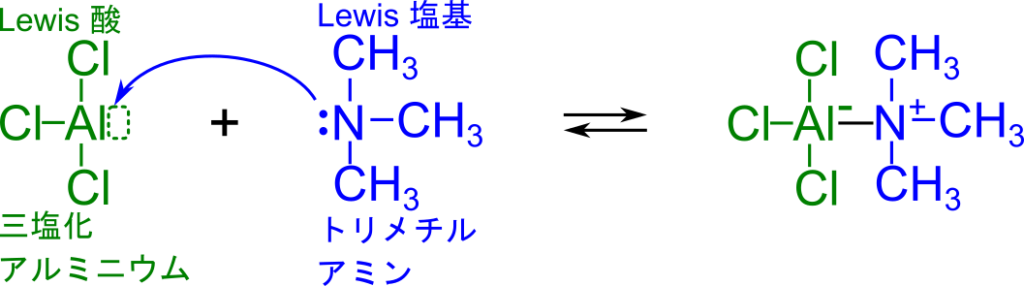
つぎの反応では三フッ化ホウ素とジメチルエーテルの反応です。この反応では
- 三フッ化ホウ素のホウ素が電子を受け取る → 三フッ化ホウ素はルイス酸
- ジメチルエーテルの窒素が電子対を供与する → ジメチルエーテル はルイス塩基

このように、ルイスの定義ではプロトンの関与の有無にかかわらず、電子対のやり取りに注目して定義します。必ずしもプロトンが関与する反応ではないことに注意してください。
各定義のまとめ
各定義についてまとめてみましょう。
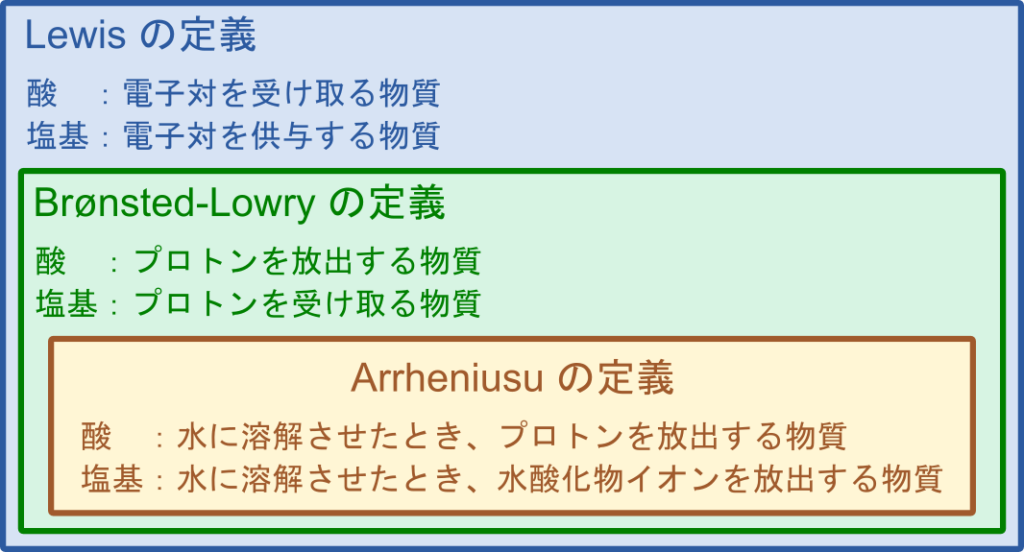
アレニウスの定義:(水に溶解させたときに放出するものに注目)
- 酸 :水に溶解させたとき、プロトンを放出する物質
- 塩基:水に溶解させたとき、水酸化物イオンを放出する物質
ブレンステッドローリーの定義:(プロトンのやり取りに注目)
- 酸 :プロトンを放出する物質
- 塩基:プロトンを受け取る物質
ルイスの定義:(電子対のやり取りに注目)
- 酸 :電子対を受け取る物質(空の電子軌道を持つ)
- 塩基:電子対を供与する物質
これらの定義はアレニウスの定義が最も狭義であり、アレニウスの定義を拡張するとブレンステッドローリーの定義、最も広義の定義がルイスの定義です。各定義が何に注目しているのかをよく確認してください。
以上、酸と塩基の定義について確認してきました。これらの定義は様々な反応の作用機序を説明する際に、よく出てくる概念の一つです。酸と塩基に複数の定義があるのは、とてもややこしく感じるかもしれませんが、この記事が各定義を整理して理解する助けとなったら嬉しいです。
参考文献
- John McMurry 著、伊東椒 児玉三明訳 (2018). マクマリー有機化学 第4版. 東京化学同人. pp. 22-27
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter 著 (2008) Molecular Biology of THE CELL Fifth Edition. Garland Science. pp. G:1, G:4