今回は前回の記事で紹介した単糖の環状構造と鎖状構造の平衡状態について、このような反応が起こるメカニズムについて書いていきたいと思います。できるだけイメージしやすいように紹介しようと思いますのでぜひ読んでいて見てください。
Contents
まずは化学結合について復習してみましょう
電荷の偏りが化学反応の起点となる
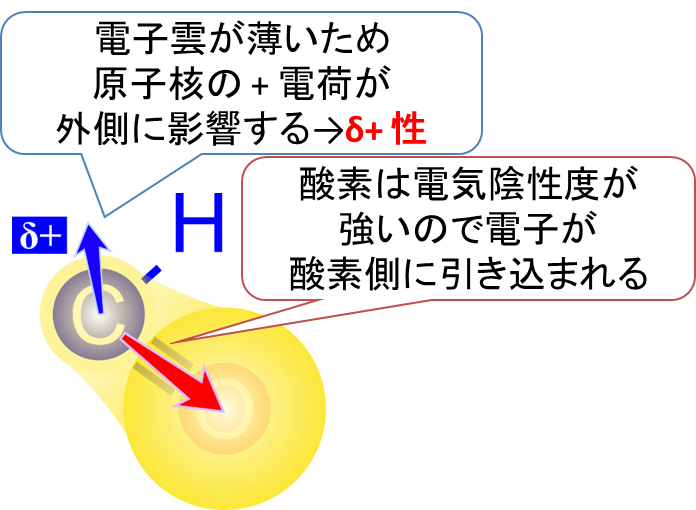
本題に入る前に、δ+ 性について説明しようと思います。炭素に比べ酸素は電気陰性度がとても強い原子です。つまり酸素は電子を引っ張る力とても強いのです(酸素は全元素の中で二番目に電気陰性度が強い元素です)。このため、炭素と酸素間の電子の局在はアンバランスになっています(図1)。
さて、原子の周りにある場合、電子は雲のような状態で存在しています。これを電子雲といいます。電気陰性度の差によって、電子雲は酸素側が濃く、炭素側が少し薄くなっています。ちょうど図1のようなイメージでとらえるとわかりやすいかと思います。
電子雲が均等に局在していると原子核の+電荷が電子のー電荷で打ち消されて電気的に中性になりますが、炭素側では電子雲が薄くなっているため、原子核が持つ+電荷を打ち消しきれなくなります。その結果、炭素原子は少し+に荷電している状態になります。この電荷は電子1個分には満たないので δ+と表現され、このような状態を δ+性といいます。この電荷の偏りは様々な化学反応の起点になりやすいので注目するべきポイントになります。
二重結合には σ 結合と π 結合が含まれる
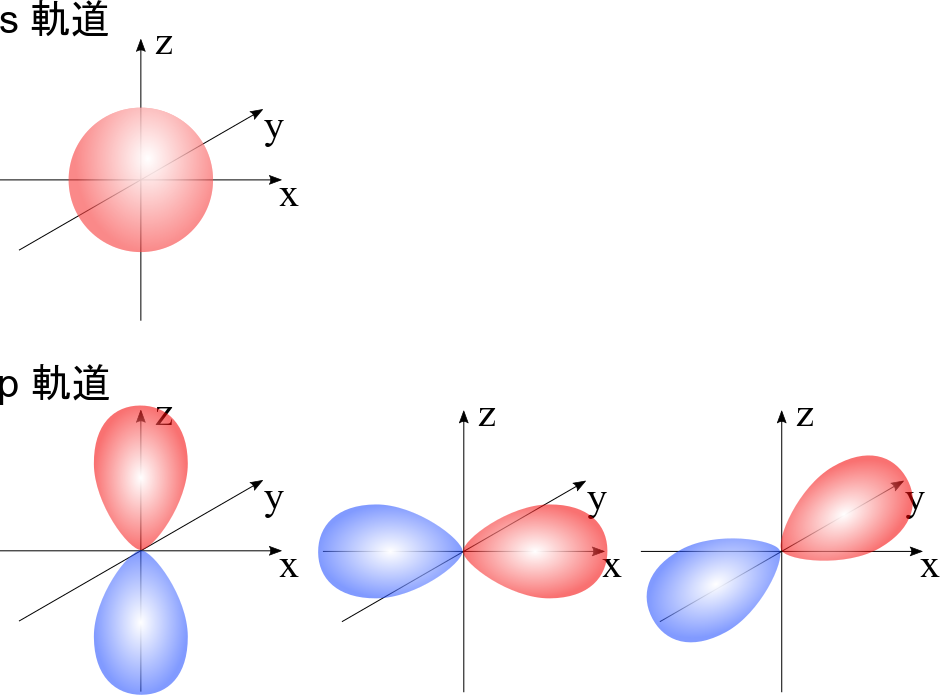
ここで混成軌道について簡単に触れておきます。詳しくは化学結合論を勉強してくださいね。通常、炭素の最外電子殻の電子配置は 2s22p2 です。ところが、この電子配置では化学結合の形状を説明できません。例えば、二重結合をもつ結合の場合は平面三角形になりますが、s軌道は球形ですし、p 軌道は3つあってそれぞれ x 軸方向、y 軸方向、z 軸方向に局在した形をしています。ここで、p 軌道は赤色と青色で合わせて一つであることに気を付けてください。さて、これらの形をどう組み合わせても、平面三角形にはなりませんね。そこで考案された概念が混成軌道です。
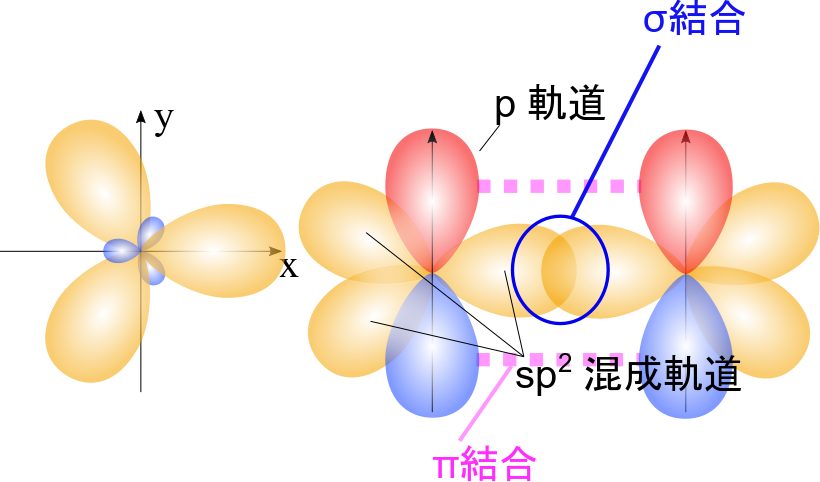
炭素で二重結合を形成する場合 s 軌道一つと p 軌道二つが混ざって新しい軌道を形成します。すると左の図のようになります。sp2 混成軌道 (左) は正三角形の各頂点に向かって伸びた形状になっています。sp2 混成軌道とp 軌道を合わせて描くと右側のようになります。二重結合は sp2 混成軌道の共有により形成される σ 結合と p 軌道の重なりで形成される π 結合の二種類の結合で形成されています。π 結合を形成する電子は p 軌道をとっているので比較的移動しやすい電子です。つまり、軌道が重なり合うことでがっちり固定されているのが σ 結合、そこまで固定されていないので状況によっては混成軌道を形成して新しい結合を作ったり、移動してしまいやすいのが π 結合と考えるとわかりやすいと思います。これが二重結合をもつ化合物が高い反応性を持ちやすい理由です。
分子内ヘミアセタール形成について
図2を見てください。まず重要なことは 5位の水酸基は立体構造上アルデヒド基と近接位置にきます。したがって5位の水酸基とアルデヒド基が反応を起こすことになります。
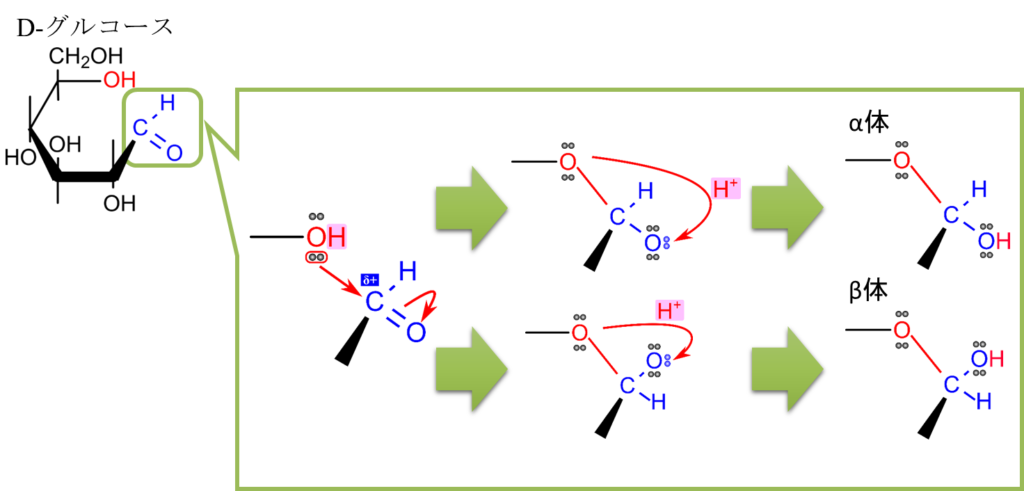
さて、図2に示すように、アルデヒド基の炭素はδ+性を有するため、5位の水酸基がアルデヒド基の炭素を攻撃します(”求核的に攻撃する” といいます。水酸基の非共有電子対(電荷-)が炭素原子(電荷+)に引き付けられて攻撃するイメージです)。この結果、炭素と酸素間に結合が形成されますが、そうなると二重結合のままでは炭素の結合の手が5本になってしまいますね。炭素の結合の手は4本なのでこれはまずいです。そこで π 電子が酸素側に遷移(移動)します。そこに水素イオン(プロトン)が結合し水酸基に変換されます。こうして5位の水酸基の酸素と1位の炭素がつながって環状構造のグルコースが形成されました。この構造はアルデヒド基とアルコールに起因するものでヘミアセタールと呼ばれます。
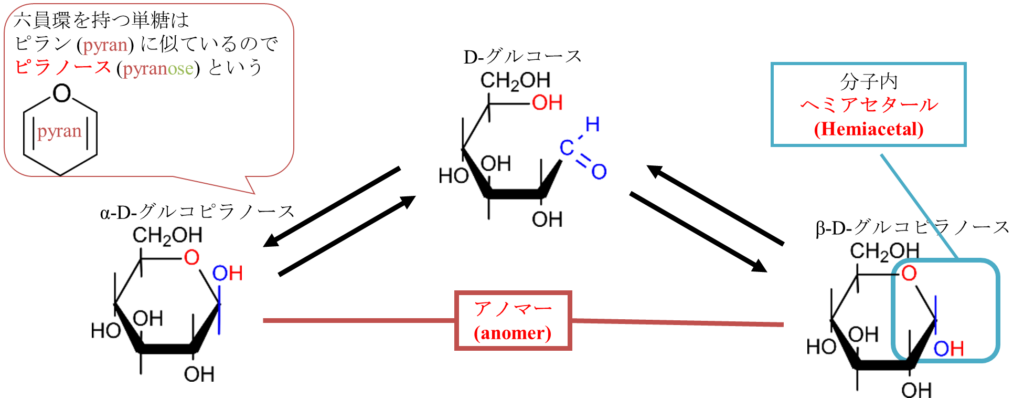
ここで図2の真ん中に注目してください。この反応が起こるときに酸素が下側に来ると環状構造を形成したときに水酸基が下向きについた構造になります(α体)。一方で酸素が上側に来ると水酸基が上向きについた構造になります(β体)。このようにして形成された立体異性体の関係をアノマーといいます(図3)。D-グルコースのように環状構造を形成した結果、六員環(六角形の構造)になった場合、ピランに似ているためピラノースと呼びます。
分子内へミケタール形成について
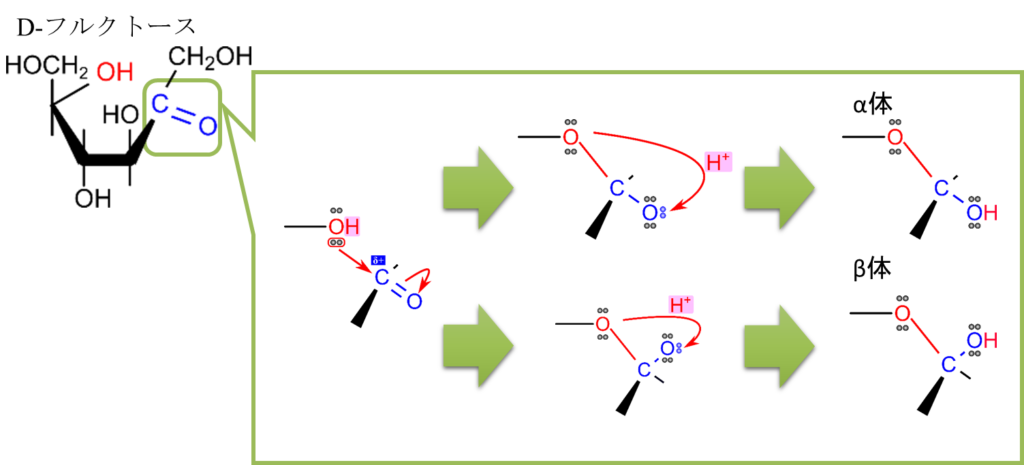
図4.を見てください。図4では D-フルクトースの環状構造形成について示しています。この反応も分子内ヘミアセタール形成と同様にして起こります。つまり、5位の水酸基がケト基の炭素を求核的に攻撃して結合を形成します。さらに、π 電子が遷移したのち、プロトンが結合し、水酸基に変換されて環状構造が形成されます。この構造はケト基とアルコールに起因するものでへミケタールと呼ばれます。ヘミアセタールと似ていますがアルデヒド基が関与するかケト基が関与するかで呼び方が変わりますので気を付けてくださいね。
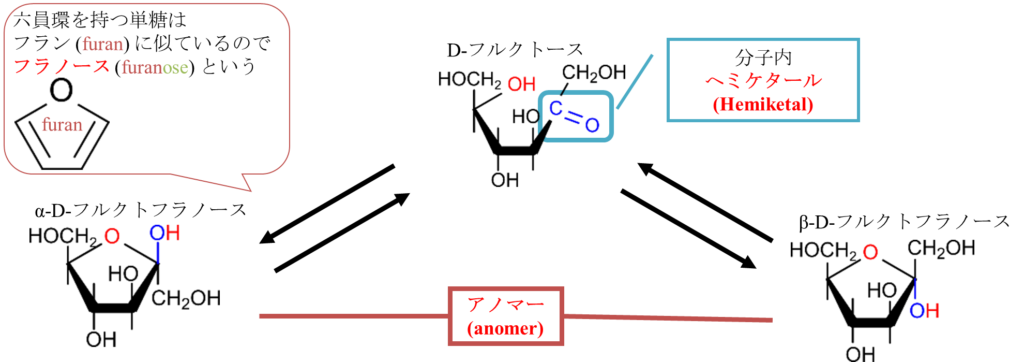
さて、D-フルクトースの場合は反応する水酸基が2通りあります図5、6にその2通りを示します。図5に示すように5位の水酸基とケト基がへミケタール形成をすると五員環(五角形の構造)になります。この構造はフランに似ているためフラノースといいます。なお、D-グルコースの時と同様 α 体と β 体も形成され、この場合にもアノマーが存在します。
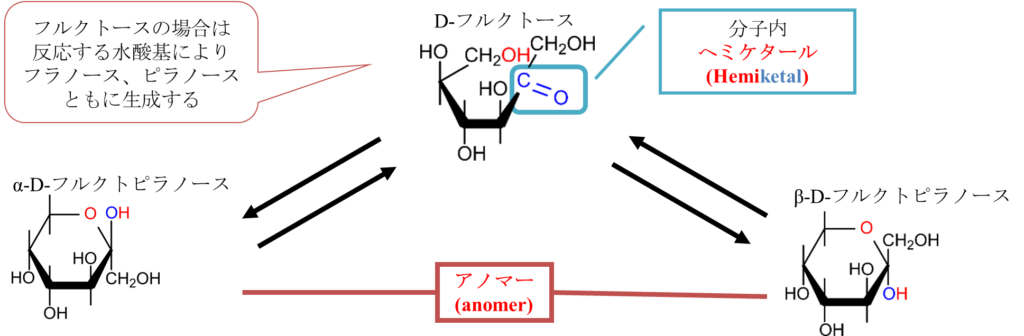
一方で図6に示したように6位の水酸基が反応するとピラノースが形成されます。この場合もα 体と β 体が形成され、アノマーが存在します。D-フルクトースの場合はフラノースとピラノースの両方が形成されるんです。
だいぶ長くなりましたが、以上が環状構造と鎖状構造の平衡状態が形成されるメカニズムの説明になります。次回は単糖の分子の形について記載しようかと思っています。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 5-34
- 2.Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 290-313
- John McMurry著、伊東椒、児玉三明訳 (2000). マクマリー有機化学 第4版. 東京化学同人. pp. 439-470
- K. P. C. Vollhardt, N. E. Schore著、古賀憲司、野依良治、村橋俊一、大嶌幸一郎、小田嶋和徳、小松満男、戸部義人訳 (2020). ボルハルト・ショアー現代有機化学 第8版. 化学同人. pp. 1425-1486
関連記事
糖鎖の基本について
糖鎖の化学反応について
糖鎖の表記方法・三文字表記について
オリゴ糖・多糖について
解糖系について
- 解糖系(glycolysis)によって糖からエネルギーを取り出しATP を生成する
- 解糖系の各反応をエネルギー的観点から読み解く
- 解糖系で利用される糖はグルコースに限らない
- 解糖系の制御は三つの律速酵素に対する調節で行われる
TCA サイクルについて