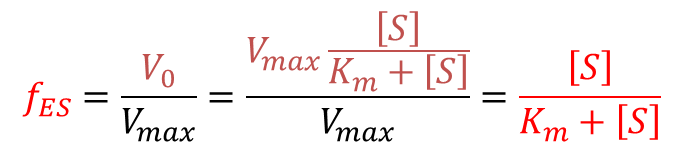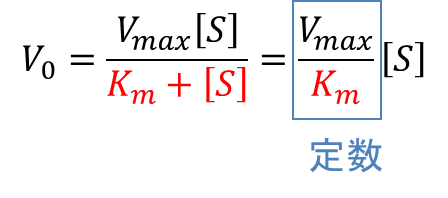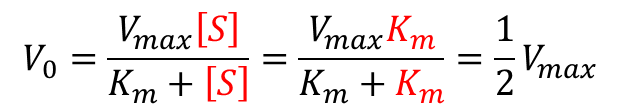酵素は化学反応の速度を速める役割を担っています。それは同時に、各反応を適切な速度で制御することを意味します。したがって、酵素が化学反応をどの程度の速度で進めることができるのかは、最も重要な特性の一つです。今回は、化学速度論の観点から酵素の特徴を読み解くための知識や手法を紹介します。
Contents
酵素反応の進行と反応速度の解析方法
まずは酵素反応が進行したときの状況についてみていきましょう。ここでは最も単純な以下のような反応について考えます。
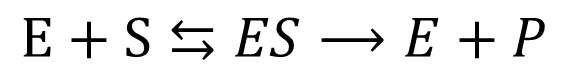
この反応をビーカー内で行います。この状況は実験的なものですので生体内で起こっている状況を必ずしも表すものではない点に注意してください。このような試験は不自然なものですが、酵素自身の特性を調べる上ではとても有効です。
さて、酵素は反応の速度を速めることができるタンパク質でした。したがって知りたい酵素の能力とは反応速度に関わるものです。反応速度は一定の時間内に基質がどれだけ減少するか、あるいは生成物がどれだけ産生されるかによって定義づけられます。ということで、基質濃度、生成物濃度がどのように変動するかを見ていきましょう(図1)。基質濃度は最初が最大で、生成物に変換されていくことで低下していき、生成物は増加していきます。したがって、[S](オレンジ)が減少していくにつれて [P](青)が増加していきます。ところで、この反応は ES 複合体形成を介して行われます。ES 複合体(緑)は一部が基質と酵素の解離方向に、一部が生成物を生成する方向に進みます。この時、ES 複合体形成と ES 複合体の崩壊が釣り合うと ES 複合体濃度は一定となり、この状態を定常状態といいます。この状態では [ES] の変化量(速度)が 0 となります([ES] の変化速度は [ES] を時間で微分すると求められます。変化量が 0 ということを数式で表すと、![]() =0 となります)。どれくらいの酵素が ES 複合体になるかは基質濃度に依存して決まります。[S] が少なければそれに見合った量が ES 複合体を形成しますし、十分に多ければすべての酵素が ES 複合体を形成します。また、定常状態への移行は極めて速く、酵素にもよりますが、通常、10-2 ~ 10-3 秒程度となります。ES 複合体形成は平衡反応ですので、反応が進んでいって基質濃度が低下していくと解離する方向が強まり、解離していきます。最後にはほぼすべての酵素が基質と解離することになります。この時の酵素濃度は酵素の初期値とほぼ一致します(ここではこの濃度を [E]0 としています)。この濃度は系に添加された酵素全体の濃度とほぼ一致する点に注意してください。
=0 となります)。どれくらいの酵素が ES 複合体になるかは基質濃度に依存して決まります。[S] が少なければそれに見合った量が ES 複合体を形成しますし、十分に多ければすべての酵素が ES 複合体を形成します。また、定常状態への移行は極めて速く、酵素にもよりますが、通常、10-2 ~ 10-3 秒程度となります。ES 複合体形成は平衡反応ですので、反応が進んでいって基質濃度が低下していくと解離する方向が強まり、解離していきます。最後にはほぼすべての酵素が基質と解離することになります。この時の酵素濃度は酵素の初期値とほぼ一致します(ここではこの濃度を [E]0 としています)。この濃度は系に添加された酵素全体の濃度とほぼ一致する点に注意してください。
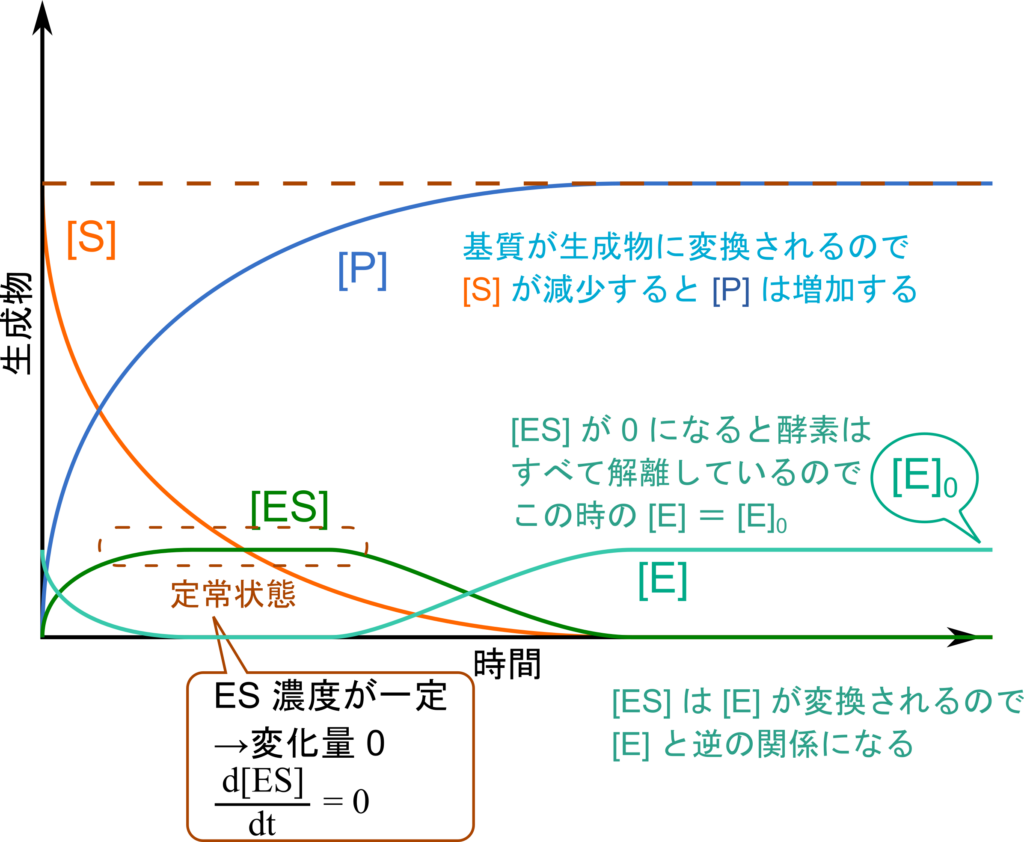
[ ] は各成分の濃度。
次に酵素活性の強さをどのように測定するのかについてみていきましょう。
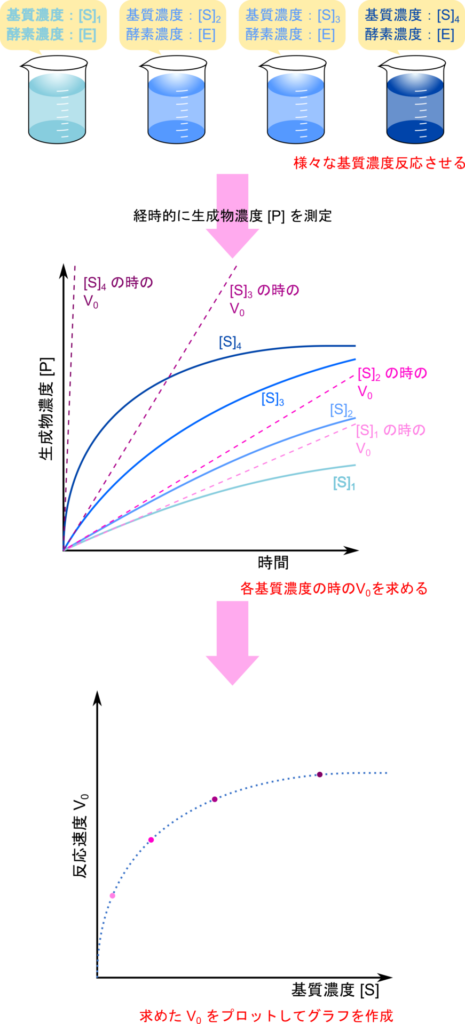
- 生成物の濃度を経時的に測定します。
- こうすることで生成物の経時変化を表すグラフが得られます。
- このことからわかるように、反応速度は生成物濃度の変化量としています。
- 次に時間 (t) が 0 の時の接線の傾きを求めます。この値が初期反応速度(V0)です。
- 反応速度は経時的に変化していってしまうので、基準となる点が必要ですが、初期反応速度はこの基準に利用されます。
- 一般に初期反応速度は反応速度を追っていく中で最も速い速度になります。
- この実験を酵素濃度を変えずに、基質濃度だけを変えて何度も行います。
- そうするとさまざま基質濃度の時の V0 が集まります。
- この V0 を初期の基質濃度に対してプロットします。
こうして得られた基質濃度に対する V0 のグラフは基質濃度の変化に対して酵素がどれだけ鋭敏に反応できるのかを表すグラフとなっており酵素活性を評価するために利用されます。
Michaelis 定数
これまで考えてきた反応式を以下のように書き換えます。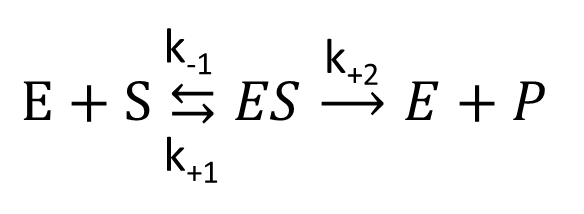
k+1 や k-1、k+2 は各反応の速度を特徴づける定数(速度定数)です。この反応は三つに分けて考えましょう。
- E + S → ES; 速度定数:k+1 ...酵素と基質が ES 複合体を形成する。
- 反応速度︰k+1 [E][S]
- ES → E + S; 速度定数:k-1 ...ES 複合体が解離して酵素と基質になる(元に戻る)。
- 反応速度︰k-1 [ES]
- ES → E + P; 速度定数:k+2 ...生成物が産生されて解離する。
- 反応速度︰k+2 [ES]
ここで、反応速度 V0 は生成物の生成速度で表されますので、
V0 = k+2 [ES]・・・(1)
となります。
ES 複合体が増加する速度は反応1のみに注目すれば求められます(赤字)。一方で、ES 複合体が失われる反応は反応2と3ですから、ES 複合体が減少する速度はこれら二つの反応速度の合計です(青字)。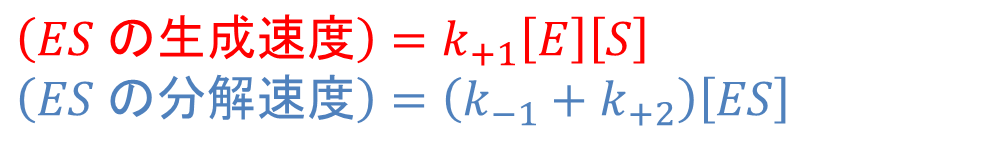
ES 複合体が生成される速度は ES 複合体が増加する速度から減少する速度を引くと求まりますので、
となります。ここで、反応が定常状態に達すると ES 複合体濃度は一定となり、変化量は0になります。したがって、
と変形できます。ここで、k+1 や k-1、k+2 はすべて定数ですので、![]() も定数となります。この定数はミカエリス定数(Michaelis constant;Km)と呼ばれ、酵素の特性を表す重要な定数です。なお、この値は pH や温度などの条件によって変わりますので、どういった反応条件で示されているのか注意が必要です。
も定数となります。この定数はミカエリス定数(Michaelis constant;Km)と呼ばれ、酵素の特性を表す重要な定数です。なお、この値は pH や温度などの条件によって変わりますので、どういった反応条件で示されているのか注意が必要です。
ミカエリス定数が示す意味について少し見てみましょう。
- 多くの場合 Km は生体内の基質濃度 [S] に近くなっています。
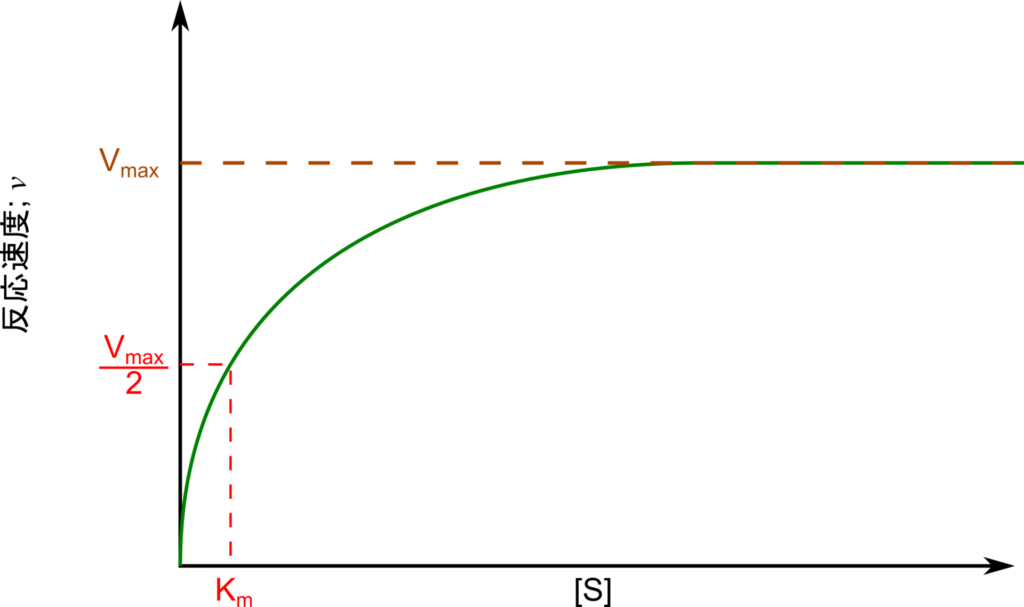
- [S] < Km の時、グラフは急になっています。[S] が少し増減するだけで V0 は鋭敏に増減しますが([S] が低い領域では、グラフ上で [S] を少し動かしただけで V0 が大きく変わります)、反応速度は遅くなります(図3)。
- [S] < Km の時、グラフは緩やかになっています([S] が大きい領域では、グラフ上で [S] を動かしても V0 それほど変化しません)。[S] の増減に対してい V0 の反応は鈍くなりますが、反応速度は速くなります(図3)。
- [S] = Km の時、反応速度は Vmax の半分になります(図3)。この時、反応速度と [S] の変化に対する反応性のバランスがとれており、生体内の反応を制御する上で適しています。
- 以上のことから、Km に近い基質濃度 [S] では、そこそこ大きい反応速度を発揮しながら、基質濃度 [S] の変化にも鋭敏に反応できますので、酵素の Km が生体内の基質濃度 [S] に近いことは有利になります。
- k+2 ≪ k-1 の時、Km はES 複合体の解離定数を表します。
- この時、ES 複合体が形成される速度より E と S への解離の方がずっと早いため、生成物が生成される反応(以下の青字部分)の影響は無視できます。

Km は以下のようになり、ES 複合体の解離定数を表します。
 ・・・(ES 複合体の解離定数になっている)
・・・(ES 複合体の解離定数になっている)
- この時、ES 複合体が形成される速度より E と S への解離の方がずっと早いため、生成物が生成される反応(以下の青字部分)の影響は無視できます。
- Km と [S] を利用することで酵素の飽和度を求めることができます。
- 活性部位が基質で占められている割合を fES とすると、fES は以下のように計算することができます。

- 活性部位が基質で占められている割合を fES とすると、fES は以下のように計算することができます。
このように、Km は酵素の様々な特性を理解する上で重要な定数です。
Michaelis-Menten の式
酵素の初期濃度を [E]0 とします。この時、[E]0 は全酵素濃度とみなすことができます。今、酵素が ES 複合体を形成すると、その分酵素が消費されますので![]()
が成り立ちます。この式を ミカエリス定数の定義式に代入して、[ES] について表すように式変形します。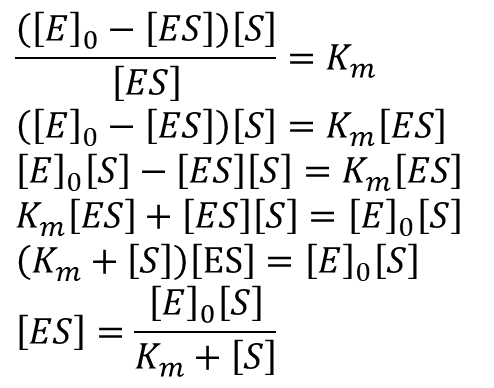
ここで、(1)より
V0 = k+2 [ES]
となりますので、これに上の式に代入すると ・・・(2)
・・・(2)
となります。ここで、基質濃度 [S] と反応速度 V0 の関係を考えます。[S] が十分に大きいと、酵素の触媒部位は基質で飽和します。この時、反応速度は最大となりますので、V0 ≃ Vmax となります(図3)。この状態では酵素がすべて基質と結合しているので、![]()
となります。したがって、(1)の式は![]()
この式を利用すると(2)の式は以下のように書き換えられます。
よって、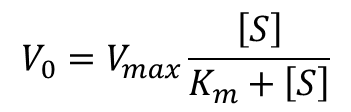 ・・・(3)
・・・(3)
が得られました。この式はミカエリス-メンテンの式(Michaelis-Menten equation)と呼ばれており、反応速度の特性をよく表しています。以下にミカエリス-メンテンの式の意味についてみていきましょう。なお、図形的なイメージは図4に示しています。参考にしてください。
- [S] ≪ Km の時([S] が十分に小さいとき)
- Km + [S] ≃ Km とみなせますので、(3)の式は以下のようになり、(Vmax も Km も [S] と無関係な定数なので)V0 は [S] に比例します。

- Km + [S] ≃ Km とみなせますので、(3)の式は以下のようになり、(Vmax も Km も [S] と無関係な定数なので)V0 は [S] に比例します。
- [S] = Km の時
- [S] = Km を代入して(3)式は以下のようになり、V0 は Vmax の半分となります。

- [S] = Km を代入して(3)式は以下のようになり、V0 は Vmax の半分となります。
- [S] ≫ Km の時([S] が十分に大きいとき)
- Km + [S] ≃ [S] とみなせますので、(3)の式は以下のようになり、V0 は一定となり、Vmax で近似されます。

- Km + [S] ≃ [S] とみなせますので、(3)の式は以下のようになり、V0 は一定となり、Vmax で近似されます。
![[S] が十分に小さいと、比例で近似でき、[S]=Km の時V0=Vmax/2、[S] が十分に大きいとき、V0は一定となり Vmax にほぼ等しくなる。](https://www.lifescience-note.net/wp-content/uploads/2025/02/g8162-989x1024.png)
代謝回転数(Turnover number;kcat)
酵素が基質で十分に飽和しているときの反応速度は以下のようになります。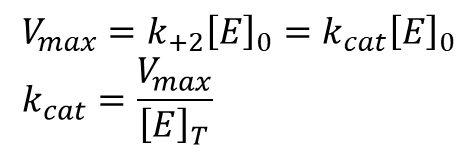
となります。この時、kcat は代謝回転数(turnover number)と呼ばれ酵素一分子が単位時間内に生成物に転換できる基質の最大数を表しています。多くの場合、kcat は 1 ~104 の範囲になります。
kcat/Km によって酵素の触媒効率を尺度化できる
基質濃度 [S] が十分に大きいとき、反応速度は Vmax となりますが、生体内では通常それほど基質濃度が大きくなることはありません。このようなとき、Vmax は反応速度を表す数値としてはふさわしくありません。そこで、反応速度をうまく表す数値を考えてみましょう。以下の式は反応速度の式とミカエリス定数の定義式ですね。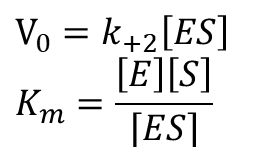
ミカエリス定数の定義式を変形して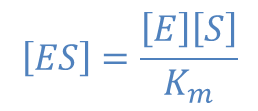
を得ますが、これを反応速度の式に代入すると
ここで、今回の主目的は [S] が小さい時の反応速度の尺度を得ることでした。そこで、[S] ≪ Km の場合を考えます。この時、酵素が複合体を形成する量は無視できるほど小さくなるので、酵素濃度 [E] は [E]0 とほぼ一致します。ですので [E] を [E]0 と入れ替えます。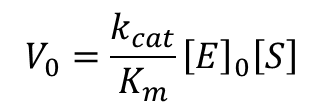
したがって、[S] ≪ Km の場合、V0 は kcat、Km、[S]、[E]0 に依存して決まります。ところで、kcat/Km は E と S が ES 複合体を形成する速度定数であり、触媒効率の尺度として利用することができます。この数値は特異性定数(specificity constant)と呼ばれています。
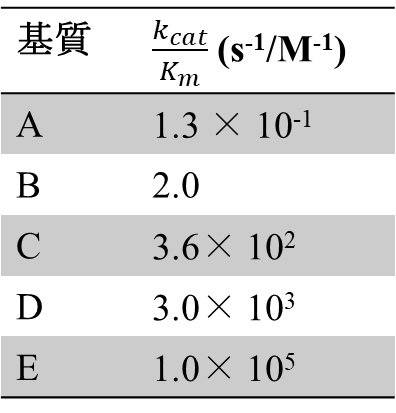
特異性定数を利用した例を示します。ある酵素の基質候補が A ~ E まであったとしましょう。これらの基質を使用した場合の kcat/Km を右の表に表します。この時、 kcat/Km は 基質 A<B<C<D<E の順になっています。これは親和性が高い順と一致します。ですので、この酵素は親和性の高い順、E、D、C、B、A の順に優先的に反応することがわかります。
Km と Vmax の求め方
これまで、Km と Vmax などの酵素の特性を表すパラメータを紹介してきましたが、これらの数値を実験的に求める方法を紹介します。
基質濃度と V0 のプロット
基質濃度 [S] と V0 をプロットすることで図3のようなグラフを得ることができます。この時、速度がほぼ一定となるときの速度が Vmax であり、V0 が Vmax の1/2 の時の [S] が Km となります。ただし、この方法では近似曲線を得る必要があり、コンピューター処理が必要となります。もし、直線的なグラフに基づいて推定することができればもっと使いやすいですね。次項目で直線に基づいた方法を紹介します。
Lineweaver-Burk プロット
ミカエリス-メンテンの式を変形します。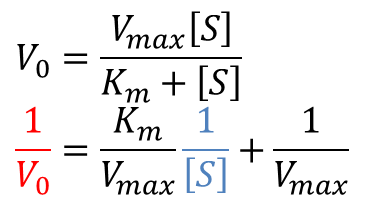
と変形できます。ここで、1/[S] = x、 1/V0 = y とおいてみると、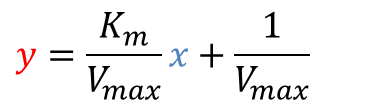
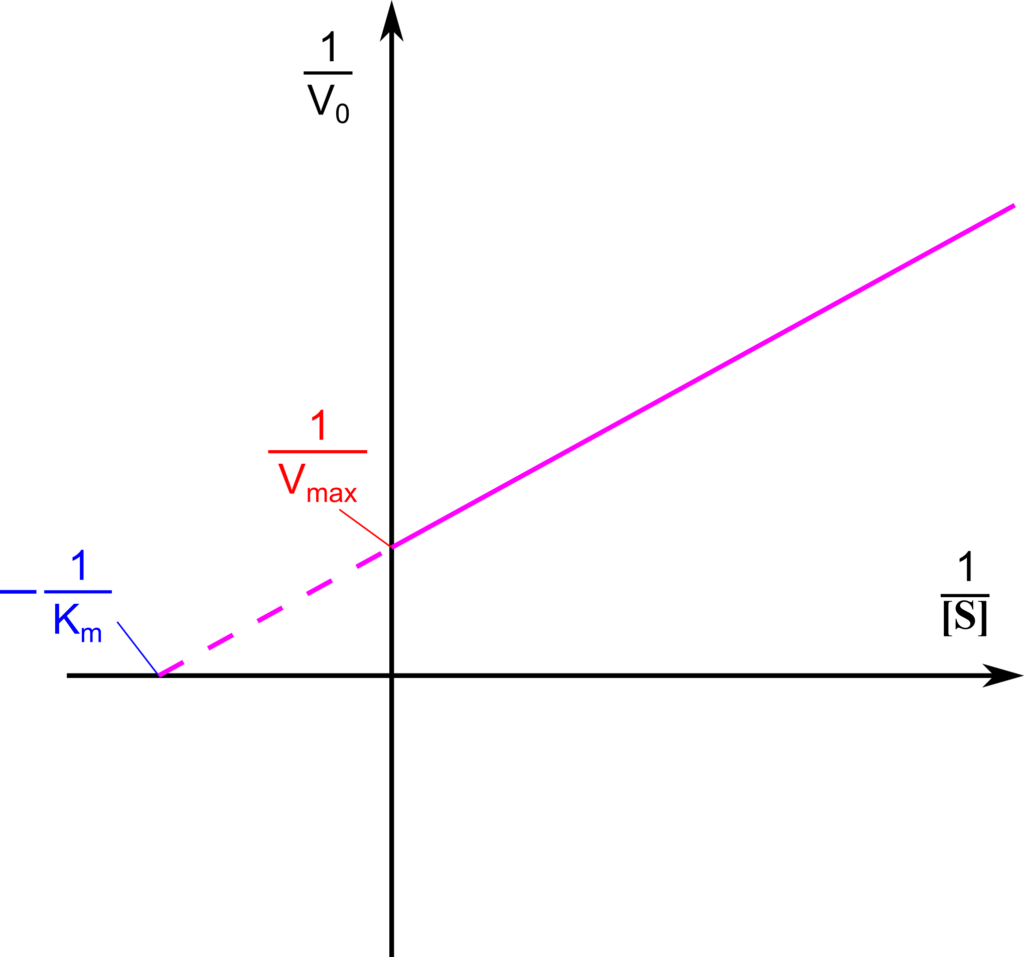
となります。これは一次関数の式となっており、y 切片は 1/Vmax、x 切片は -1/Km ですので、y 切片及び x 切片から Vmax と Km を求めることができます。このような方法を Lineweaver-Burk プロット(二重逆数プロット;double-reciprocal plot)といいます(図5)。
今回は酵素反応の化学反応論についてみてきました。数学的な内容が多くて少しとっつきにくく感じるかもしれませんが、式変形自体はそれほど難しくありません。ただし、時間と生成物濃度の関数についての議論なのか、基質濃度と反応速度の議論なのかが混同しやすいので、この点は気を付けてください。
今回紹介した内容は、酵素の活性を理解したり、酵素阻害剤について理解する上で重要な知識となりますので、よく勉強して理解してください。
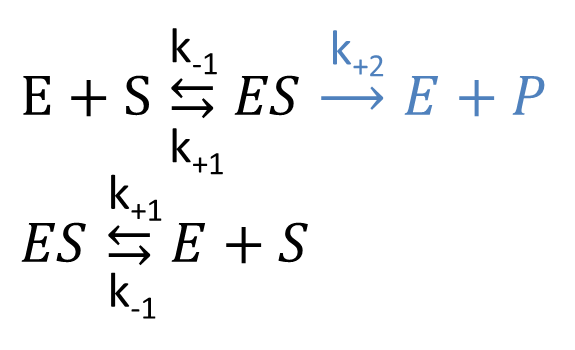
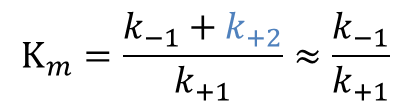
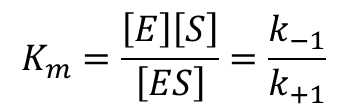 ・・・(ES 複合体の解離定数になっている)
・・・(ES 複合体の解離定数になっている)