生体内ではエネルギーを生み出したり、必要な物質を生み出したりと様々な形で化学反応が活躍しています。これらの化学反応は必要なときに機能し、必要がなくなれば止まるように制御されています。このコントロールは酵素をうまく利用することで実現されています。今回は酵素の基礎知識について概説していこうと思います。
Contents
酵素の定義と触媒作用
酵素とは触媒作用を持つタンパク質のことを言います。酵素が作用して触媒される物質を基質(substrate)と呼び、反応の結果産生される物質を生成物(product)といいます。ある化学反応が必要になった場合、生体内では酵素が活性化したり、産生されたりすることで必要な化学反応が誘導されます。一方で必要がなくなった場合は酵素が阻害を受けたり、酵素の産生が止められたりして反応が止められます。このように、酵素は生体内の化学反応を適切にコントロールする重要な役割を担っています。
触媒とは
酵素についてみていく前にまずは触媒(catalyst)についておさらいしてみましょう。触媒はある化学反応を促進するもので、反応の前後で自身は変化しないものを言います。
触媒は反応を促進するだけですので、そもそも起こらないような反応を進める能力はありません。例えば、エネルギーが低いほうから高いほうに向かうような反応はエネルギーを与えないと進まないので、ATP のような分子からエネルギーが供給されないと反応は進みません。
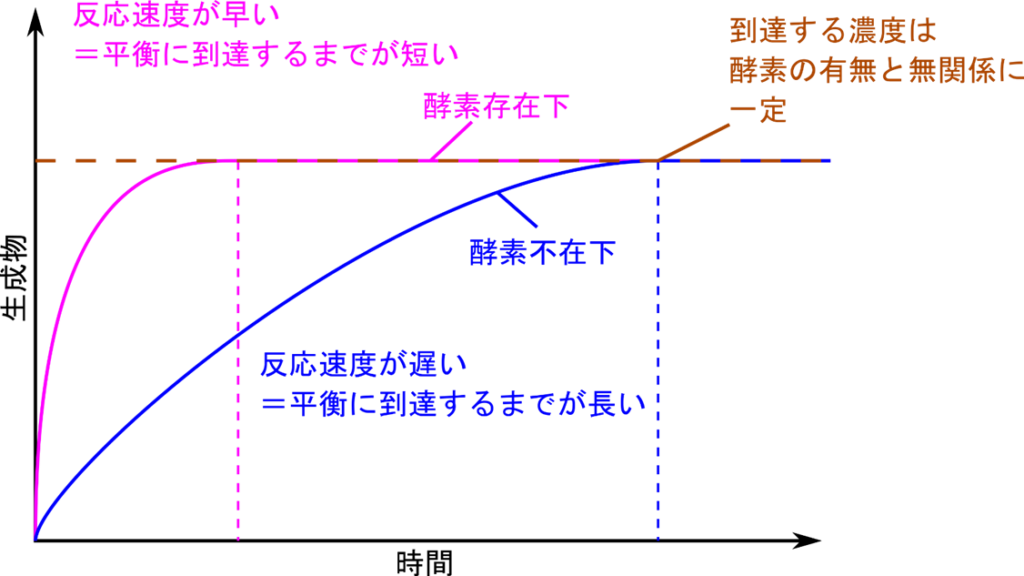
また、化学反応で得られる生成物濃度の最大値を上昇させるような効果も持ちません(図1)。多くの化学反応では基質から生成物が生成される反応と生成物が基質に戻る反応がバランスすることで化学平衡(Chemical equilibrium)を形成し、見た目上反応が止まります。この時の生成物濃度は最大となりますが、触媒の効果ではこの最大値を上昇させるような効果を持ちません。触媒の効果は飽くまでも化学反応を促進するものであることは忘れないでください。
それでは触媒の持つ促進効果とはどういうものでしょうか?触媒は化学反応の速度を速めることで化学反応にかかる時間を大幅に短縮します(図1)。図1では縦軸に生成物濃度、横軸に時間をとって生成物濃度の経時的な変化を表しています。この反応では、触媒(酵素)がないと青のラインようなグラフになります。ピンクのグラフは触媒(酵素)存在下の反応を表しています。さて、このようなグラフで反応速度はグラフの接線を引き、その傾きを求めることで算出できます(時間で微分する)。もう少し感覚的には、グラフの立ち上がり具合を見ると反応速度がわかるということになります。青のラインでは立ち上がりが緩やかで平衡(茶色の破線)に至るまでに時間がかかっていることがわかります。一方で触媒(酵素)を添加すると(ピンクのグラフ)、速やかに立ち上がり、平衡に到達する時間が短くて済むことがわかります。この効果こそが触媒の持つ促進効果です。ただし、上述もした通り平衡に到達したときの生成物濃度(茶色の破線)は触媒の有無にかかわらず一定です。つまり、酵素では生成物濃度に影響を及ぼすことはできないということがわかります。
触媒の効果と活性化エネルギー
さて、反応速度が速まるとはどういうことでしょうか?今、ある基質 S(Substrate)を生成物(Product)に変換する反応を考えましょう。この反応は ΔG のエネルギーが発生する反応(発エルゴン反応)です。ですので基本的には自発的に進む反応です。ところが、実際にはどんどん進む反応というわけではありません。これは活性化エネルギーというエネルギー的な障壁があるためです(図2)。この反応を進行させるためにはこの障壁を超えるエネルギーを与える必要があります。基質分子の一部は高エネルギー状態になることがあり、この基質分子が活性化エネルギーを超えるエネルギーを持っていると反応が進みます。このような分子が出現する頻度は活性化エネルギーが高ければ高いほど小さくなります。ですので活性化エネルギーが高い場合には少しずつしか活性化エネルギーを超える分子が出てこないため、反応速度が遅くなります。
触媒にはこの活性化エネルギーを低下させる役割があります。触媒存在下では基質と複合体を形成したのちに生成物を産生する経路をたどります(もちろんこの時に触媒は元に戻ります)。複合体形成は元の活性化エネルギーよりも小さい活性化エネルギーしか必要としません。活性化エネルギーが低下すると反応速度が速くなります。このように、触媒を利用することでより活性化エネルギーの低い経路を提供することで反応速度が速くなります。
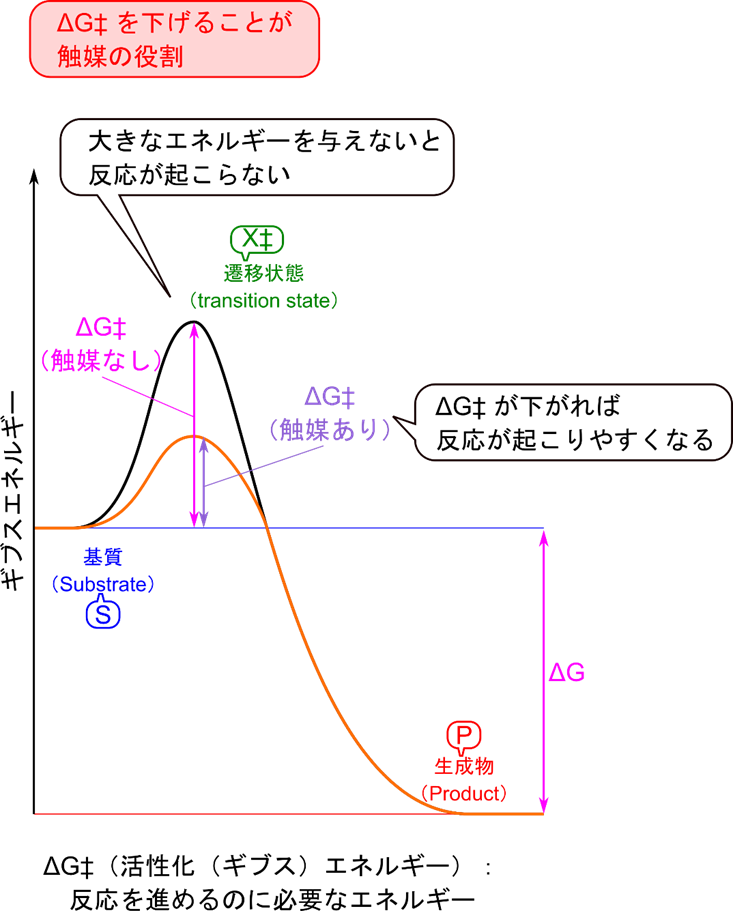
ΔG:ギブスエネルギー変化 ΔG‡:活性化エネルギー
X‡:遷移状態(基質→生成物の過程の中で一番エネルギーの高い状態)
※Gはギブスの自由エネルギーのことを言います。ギブスの自由エネルギーについてはこちらの記事のコラムで詳細を解説しています。ここでは化学反応で発生するエネルギーや各物質が内包しているエネルギーくらいに考えてください。
酵素の特性
ここからは酵素についてみていきましょう。酵素には以下のような特徴があります。
- 基質特異性が高い
- 触媒効率が極めて高い
- 熱、酸・アルカリで変性して機能を失いやすい
- 至適温度、至適 pH がある
酵素は作用する基質が厳密に決まっている
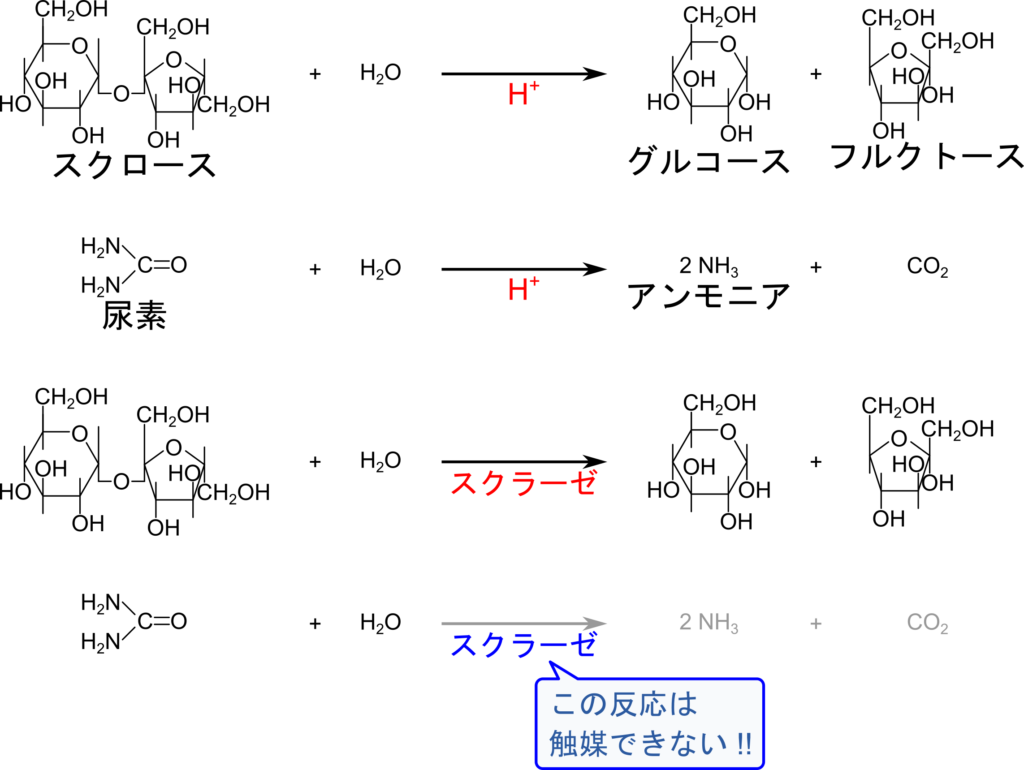
基質特異性は酵素の最も重要な特性です。触媒には同じ物質が異なる反応を触媒する場合があります。例えば水素イオンはスクロースをグルコースとフルクトースに加水分解する反応を触媒します。一方で尿素に作用させると尿素を加水分解してアンモニアを産生する反応も触媒します。一方でスクラーゼはスクロースの加水分解は触媒しますが、尿素の加水分解を触媒することはありません(図3)。このように酵素は作用する基質が厳密に決まっており、この特徴を基質特異性(Substrate specificity)と呼んでいます。これは多種多様な化学反応がある生体内で反応を適切にコントロールする上でとても重要な特性です。
至適温度と至適 pH は機能する環境と関連している
酵素には至適温度と至適 pH が存在します。酵素は働く状況に応じた至適温度を持っています。例えば哺乳類の酵素は体温付近に至適温度を持つ場合が多く、体温付近で最も活発に働くようになっています。一方で至適 pH でも機能する環境に適した至適 pH を持っており、例えばペプシンは胃で機能するため至適 pH は 1.8 ~ 2.0 であり、酸性域にあります。一方で同じような消化酵素でもトリプシンは十二指腸(消化物が中和された後)で機能するため、至適 pH は 8.0 付近にあります。ただし、多くの酵素では至適 pH は中性付近にあるります。至適温度や至適 pH は酵素活性を研究する上でとても重要な特性でもあります。
酵素の種類とEC番号
酵素は以下の 7 つに大別されます。
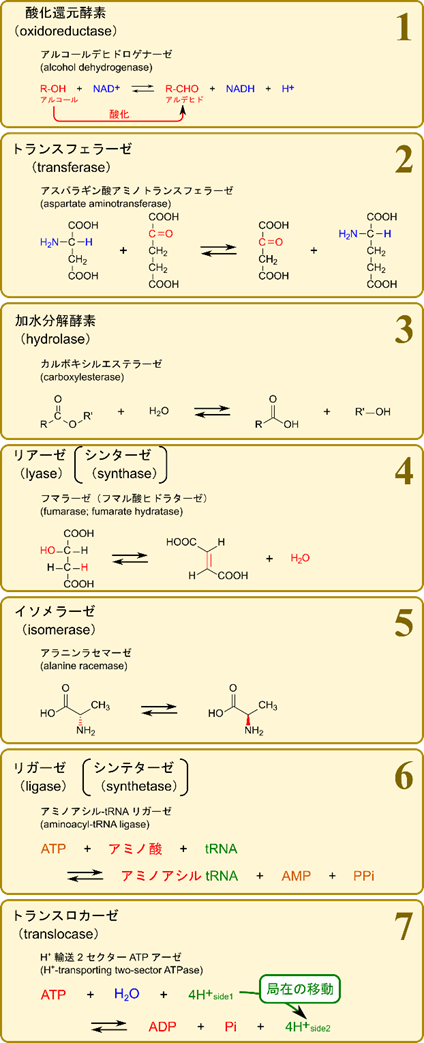
- 酸化還元酵素(oxidoreductase)
- 酸化還元反応(電子やプロトンのやり取りをする反応)を触媒します。NADH や NADPH などが関与する場合があります。
- トランスフェラーゼ(transferase)
- ある化合物からもう一方の化合物へ原子団(置換基など)を転位する反応を触媒します。
- 加水分解酵素(hydrolase)
- 加水分解反応を触媒します。
- リアーゼ(lyase)
- 基質から非加水分解的に原子団を取り去って二重結合を残す反応を触媒します。
- 二重結合に原子団を付加する反応を触媒します(上の逆反応)。
- シンターゼ(synthase)とも呼ばれます。
- イソメラーゼ(isomerase)
- 異性体間の相互変換(立体異性体間の変換や構造異性体間の変換)を触媒します。
- e.g. L-アラニンとD-アラニン間の変換、グルコースリン酸とフルクトースリン酸間の変換など。
- リガーゼ(ligase)
- ATP などの加水分解と共役して2種類の基質を縮合する反応を触媒します。
- ATP や GTP などの高エネルギー分子の消費を伴います。
- トランスロカーゼ(translocase)
- 細胞膜を超えたイオンや分子の移動を触媒します。
- ATP の消費がある場合もあります。
酵素には機能に従って酵素番号(EC 番号;Enzyme Commission numbers)が割り振られています。EC 番号は4つの数字から成り立っています。この最初の数字は酵素の7つの分類に従って付けられます。この番号は上述の番号に対応させています。例えば、EC 1.1.1.1 はアルコールデヒドロゲナーゼを意味しますが、この番号は以下のような意味を持ちます。
- 酸化還元酵素に属する
- 第一級又は第三級アルコールを基質とする
- 補酵素 NAD+ あるいは NADP+ を必要とする
- 1番目の酵素
なお、2番目の番号は副群、3番目の番号は副々群、4番目の番号は副々群内での通し番号です。2番目以降の番号が意味する内容は覚える必要はありませんが、最初の番号の分類とEC番号の意味は知っておいてください。ちなみに、少し古い教科書では酵素の分類は6つとされていました。7番目のトランスロカーゼはもともと6種類の分類で分類していたのですが、見直した結果、従来の6分類では分類が困難だということになり、2018 年に追加されました。ですので、現在の分類は7種類となっています。
酵素反応の形式
酵素反応ほとんどは以下のような2基質、2生成物です。![]()
複数の基質が関与する反応は以下の二種類があります。
- 逐次機構(sequential mechanism)
- 複置換(double displacement; ピンポン機構; ping-pong mechanism)
逐次機構(sequential mechanism)
逐次機構では関連する基質すべてが一度酵素に結合し、反応を経たのちに生成物が解離します。この機構には基質の結合する順序に従ってさらに二種類に分けられます。二つの機構についてみていきましょう。
定序逐次機構(ordered sequential mechanism)
乳酸デヒドロゲナーゼはピルビン酸を NADH + H+ を消費して還元し、乳酸を生成します。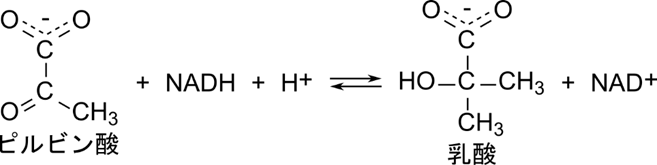
この反応では、まず NADH が酵素と結合し、次にピルビン酸が結合します。ピルビン酸の還元が行われたのち、乳酸が脱離し、最後に NAD+ が脱離します。このように基質と酵素の結合と反応、生成物の脱離の順番が決まっている反応を定序逐次機構といいます(図5)。
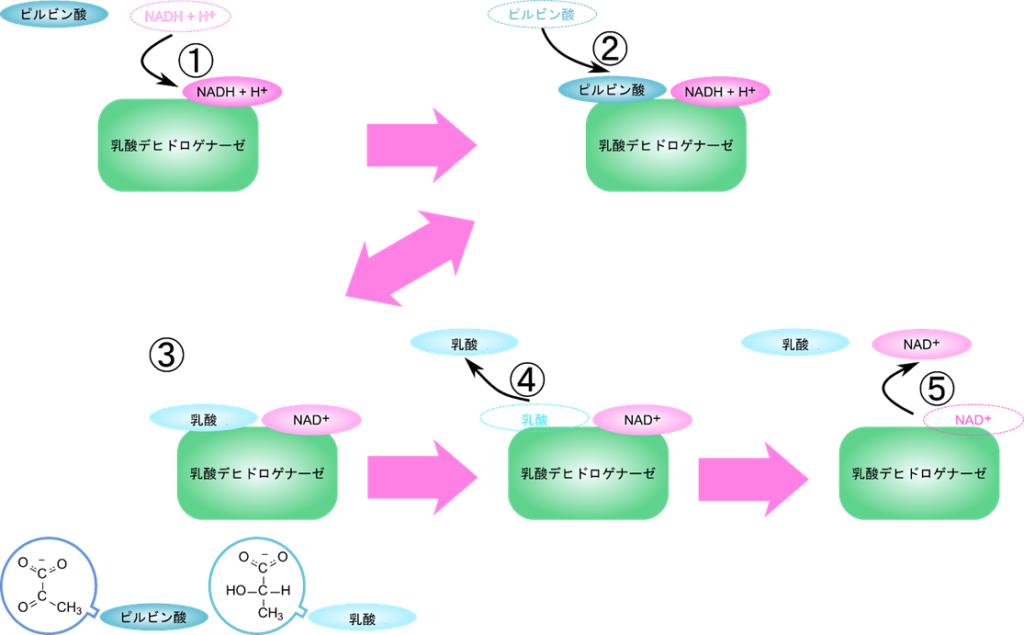
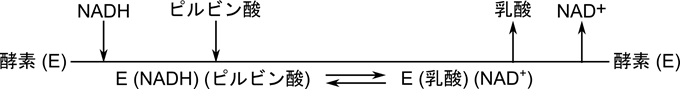
このような基質と酵素の結合や生成物の脱離を線分を使って表したものをクリーランドの表示法といいます。横線に向かう矢印は酵素への結合を、逆向きの矢印は脱離することを意味しています。例えば下のクリーランド表示は乳酸デヒドロゲナーゼの反応機構を表します。
ランダム機構
クレアチンキナーゼは以下のように ATP を消費してクレアチンをホスホクレアチンに変換します。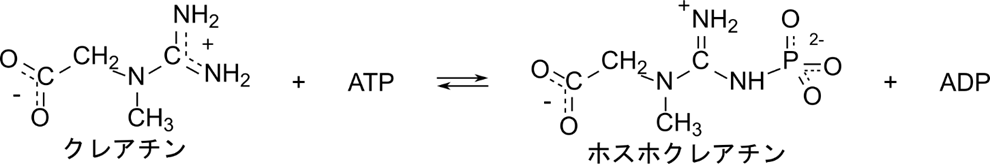
この反応では定序逐次機構とは異なり、クレアチンや ATP が結合する順番やホスホクレアチンや ADP が脱離する順番が決まっていません。クレアチンと ATP が順不同で結合したのち、ホスホクレアチンへの変換が起こり、ホスホクレアチンと ADP も順不同で遊離します。
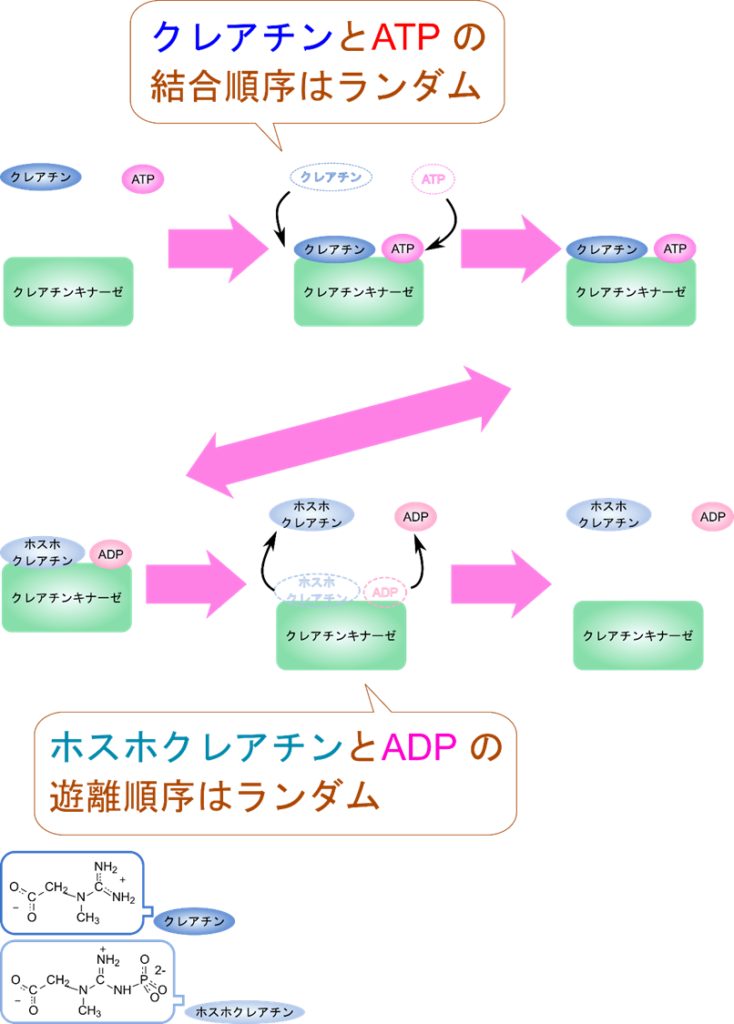
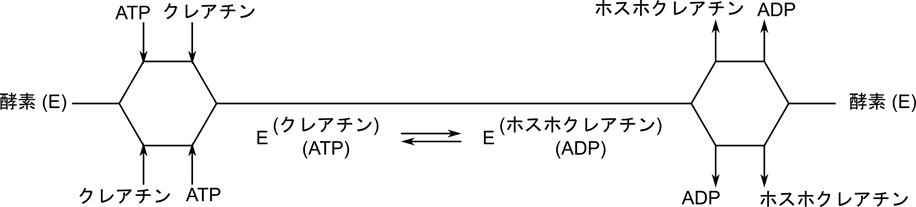
クリーランド表示では以下のようになります。ランダムな結合が起こる場合は分岐により表します。分岐した場合は上側の順番と下側の順番のいずれかをとることを表します。例えばATP とクレアチンの結合準は ATP →クレアチンの順か、クレアチン→ ATP の順のいずれかですので、それぞれの場合を表す経路を分岐により表しています。
ピンポン機構(ping-pong mechanism;複置換;double displacement)
アスパラギン酸アミノトランスフェラーゼに代表されるアミノトランスフェラーゼは一つ目の基質が結合したのち、アミノ基を酵素上に転位させ、2-オキソ酸を遊離させ、二つ目の基質を結合させてアミノ基を転位させてアミノ酸を遊離させる順で反応します。このように一つ一つ結合しては脱離していく機構をピンポン機構と呼んでいます。
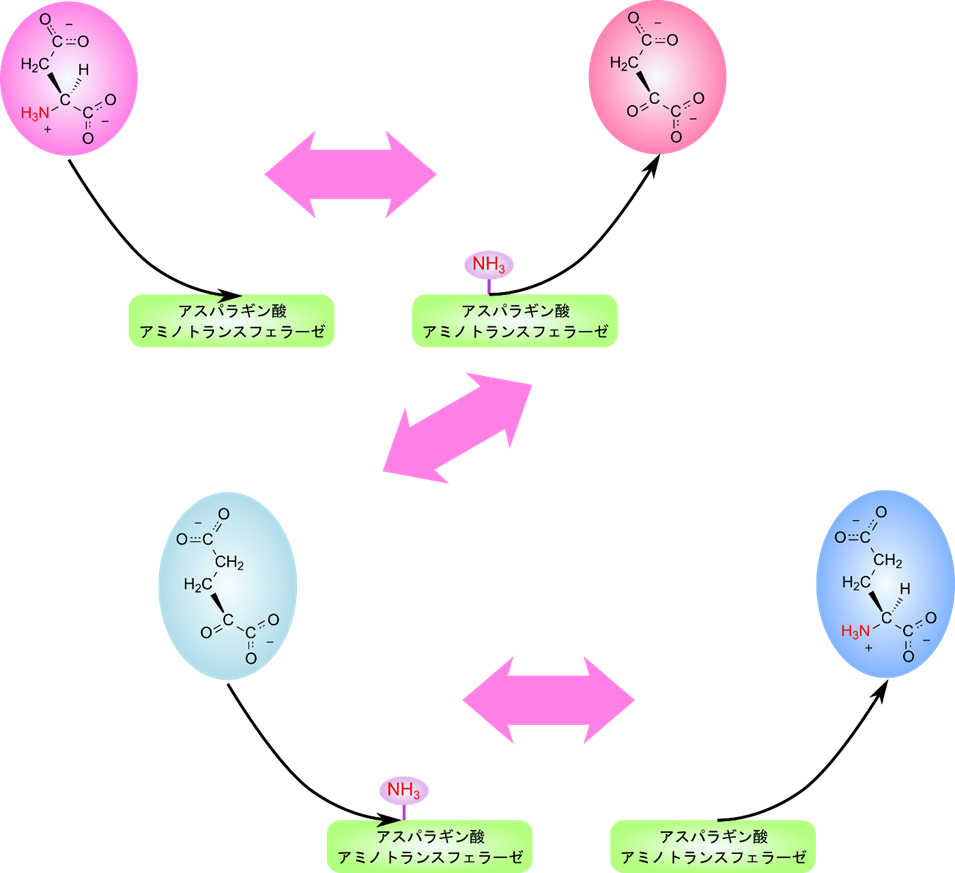
この機構をクリーランド表示で表すと以下のようになります。アスパラギン酸が結合すると E(アスパラギン酸)複合体が形成され、アミノ基を酵素に転位してアスパラギン酸がオキサロ酢酸に変換されます。(E-NH3)がアミノ基を受け取った酵素を表します。脱離します。次に 2-オキソグルタル酸が結合し、複合体を形成後アミノ基を受け取ってグルタミン酸に変換され、グルタミン酸が遊離します。この時酵素は E に戻ります。
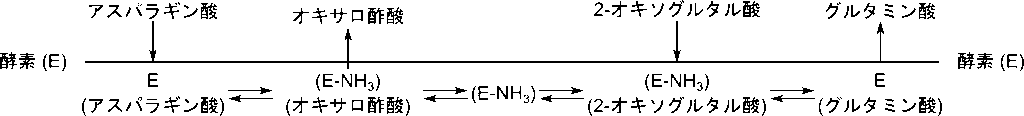
今回は酵素の基本的な特性や反応機構、分類について解説してきました。今回紹介した内容は酵素の分野でも一番基礎的な内容で、今後酵素の勉強を進める上で前提となる内容です。例えば酵素の能力を測る場合はどれくらい反応速度を速めることができるかを考えますし、酵素がどの気質に特異性を発揮するのかはそれぞれの酵素がどういった反応をコントロールするのかを理解する上で重要です。今回の内容は今後の基礎となる内容になりますので、ぜひしっかり勉強してください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 92-122
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp.198-262
- McDonald, A. G., & Tipton, K. F. (2023, May 1). Enzyme nomenclature and classification: the state of the art. FEBS Journal. John Wiley and Sons Inc. https://doi.org/10.1111/febs.16274