生体内で、遺伝情報がどのように正確に伝達され、機能しているのでしょうか?その鍵となるのは「塩基対」です。今回は、プリン塩基とピリミジン塩基がどのようにペアを形成し、その構造がどのように安定性を保ちながら、遺伝子の正確な伝達に貢献しているかを解説します。
Contents
プリン塩基とピリミジン塩基が対を形成する
塩基はプリン塩基(アデニン、グアニン)とピリミジン塩基(シトシン、チミン、ウラシル)がセットになって対を形成します。この対のことは塩基対(base pair)といいます。ところで、塩基対はどういう力でペアを形成するのでしょうか?その力の源泉は水素結合(hydrogen bond)1)です。水素結合は弱い結合ではありますが、核酸は多数の塩基を有するため、水素結合も多数含むため安定した構造をとることができます。
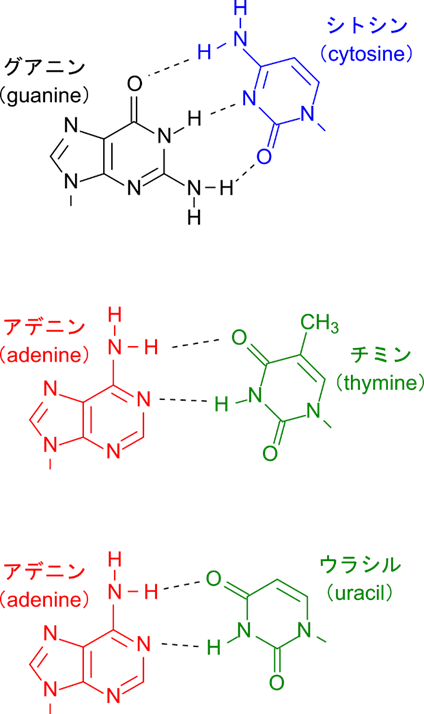
塩基対は常に決まったペアが塩基対を形成します。このペアはシトシン(C)とグアニン(G)、チミン(T)とアデニン(A)、ウラシル(U)とアデニン(A)のペアです。このペアの規則性は DNA や RNA が情報を転写する際に重要な特性になります。
さらに、シトシンとグアニンのペアが形成する塩基対はチミンとアデニン、ウラシルとアデニンが形成する塩基対よりより強固です。図1に示すようにシトシンとグアニンのペアでは水素結合が三つ形成される一方で、チミンとアデニン、ウラシルとアデニンのペアでは二本しか形成されません。その結果、グアニンとシトシンはより強い結合を、チミンとアデニン、ウラシルとアデニンのペアではより弱い結合を形成することになります。この点は遺伝子工学的な実験を設計する上でとても重要なポイントになります。ここでは詳しい内容を記述することは避けますが、遺伝子工学では人為的に設計した DNA 断片や RNA 断片を利用して生体から抽出してきた核酸に作用させる実験が多く行われます(ハイブリダイゼーションとか PCR(polymerase chain reaction)反応が代表例です)。この時に使用する DNA 断片や RNA 断片の特性として重要なのは、ちょうどよく結合するということです。もし、強く結合しすぎる場合はたまたま似た配列まで検出してしまい、偽陽性を返してしまいますし、逆に弱すぎると適切な配列も検出できず偽陰性を返してしまいます。この時の結合の強さは配列の長さなどいくつかのファクターが関与しますが、その中でも重要なファクターが GC 含量(グアニンとシトシンの含有率)です。
DNA は二重らせん構造をとる
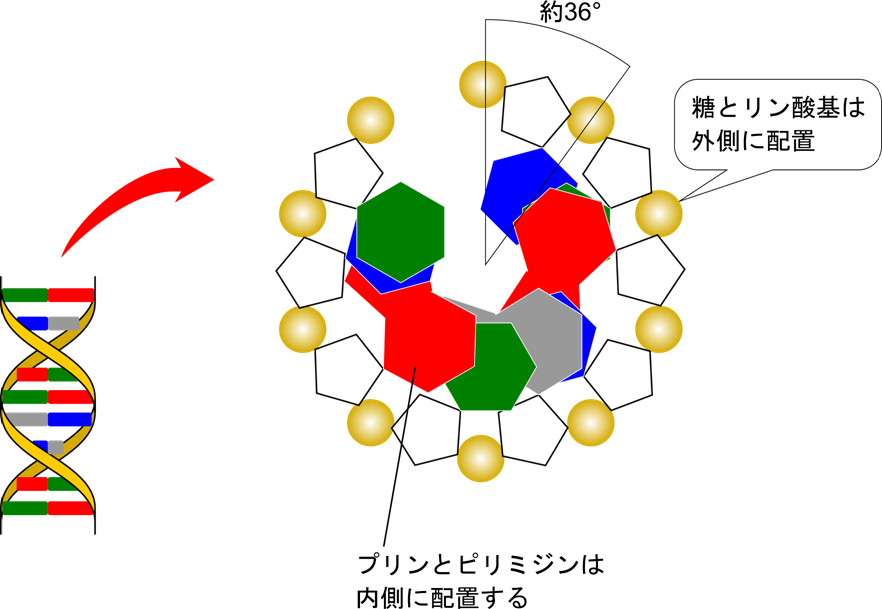
DNA は二本の鎖が互いに会合してらせん構造をとっています。DNA の二本鎖は互いに相補的で、逆向き(一方が 5′ → 3′ 方向になっているとき、もう一方は 3′ → 5′ 方向になっています)になっています。さらに、らせん構造の外側には親水性であるリン酸基とデオキシリボース(糖)が配置して、疎水性である塩基はらせんの内側に配置します。このような配置をとることで生体内のような水環境下でも安定して存在することができます。ヌクレオチドは一つ当たり右回りに 36° 回転(10.4 塩基で一周)します。塩基は内側で積み重なるような配置をとっており、塩基同士がファンデルワールス力2)で引き合うことで集まり、安定化しています。
DNA はいくつかの構造をとる場合があります。通常は上述のような構造をとりますが、この構造は B 形 DNA らせんといいます。DNA がさらに水分を失うと A 形 DNA という構造をとります。この構造はらせん構造をとりますが、B 形 DNA らせんよりも短く太くなります。一方で Z 形という第三の形態もあり、Z 形は左巻きでリン酸基の配置がジグザグになっています。このように DNA は二重らせん構造だけでなく、他にも様々な構造をとることがあります。
RNA は極めて不安定であり、DNA は安定である
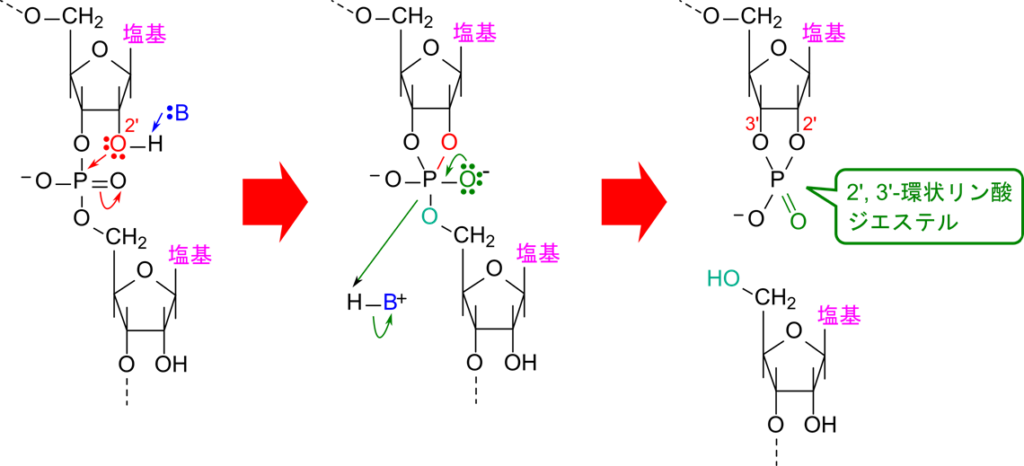
RNA はリボースの 2′ 位の水酸基が求核試薬として機能するために分解されやすいという特性があります。図3に RNA が切断される反応のメカニズムを記載しています。リボースの 2′ 位の水酸基がリン酸基のリン原子を求核的に攻撃することから反応が始まります。すると図3の真ん中のように、リン酸と2′ 位、3′ 位の間に結合が形成されて環状構造を形成します。さらに、リン酸と隣のヌクレオチドの 5′ 位の酸素との結合が切断されて、右端のような 2′, 3′-環状リン酸ジエステル構造という環状構造が形成されます。結果として RNA は切断されてしまいます。ところで 2′ 位の水酸基がなければ、そもそもこの反応は進まないと思いませんか?まさに DNA は 2′ 位の水酸基が水素に置換しているため、図3の反応は DNA では起こりません。このため、DNA はとても安定している一方で RNA は極めて不安定です。
さて、RNA が不安定であるという事実は遺伝子工学実験ではとても重要です。実は DNA はとても扱いやすい物質です。一方で RNA は扱いに気を付けないと簡単に崩壊してしまいます。RNA を扱うときは特に清潔に保つ、手袋を使用する、超低温保存するなど扱いに気をつけましょう。
DNA ではなぜチミンが採用されているのか?
まず DNA と RNA の役割の差について確認していきましょう。DNA は遺伝情報を維持するとともに次世代に伝えることが役割ですので、RNA ほど多く合成されることはありません。一方で RNA は機能を発揮する必要があるため大量に合成される必要があります。
ところで、チミンはウラシルから合成されますが、その過程で NADPH が消費されます。なお、NADPH は NADH 同等とみなせます。「四つの複合体が連動して機能するプロトンポンプ、電子伝達系」という記事でも紹介しましたが、NADH は酸化的リン酸化により 2.5 ATP を産生します。ですので、NADPH が消費されるということは 2.5 ATP を余分に消費することを意味します。したがって、チミンはウラシルから見ると余分にエネルギーが必要な “高価” な塩基といえます。
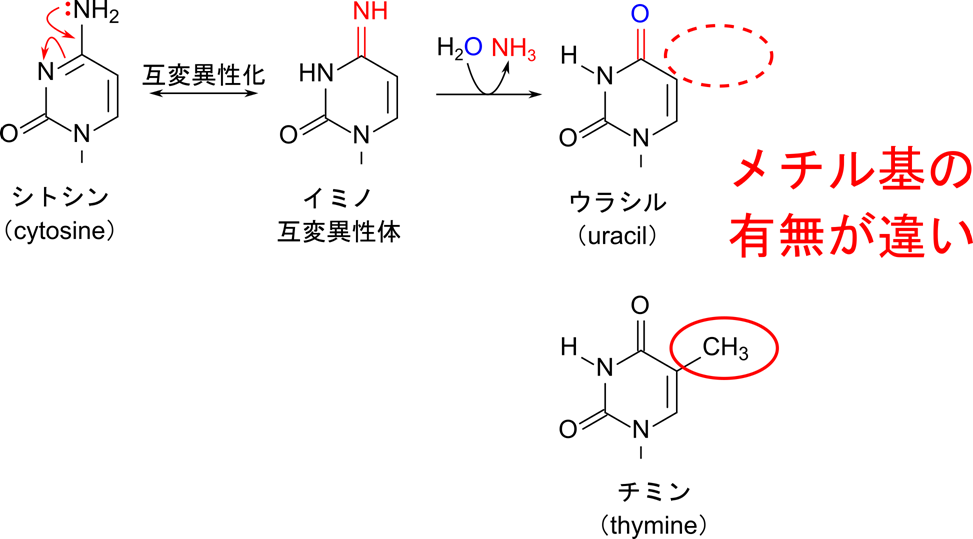
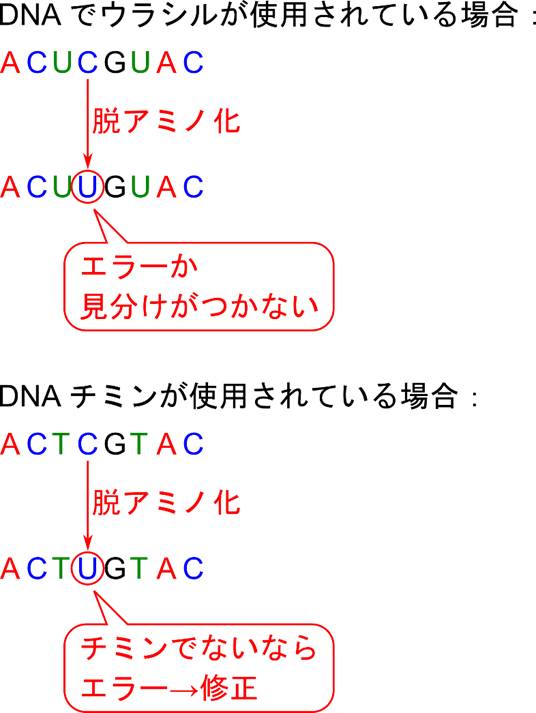
ではチミンを利用する利点は何でしょうか?チミンを利用する意味を理解するためにはシトシンの脱アミノ化(deamination)について理解する必要があります。シトシンは互変異性を持っており、容易にイミン(NH= 基を持つ化合物)を生成します。その後、脱アミノ化することによりウラシルへ変換されてしまいます。この反応が起こると本来シトシンだったはずの配列がいつの間にかウラシルに変換されてしまうということが起こってしまいます。ウラシルを採用している場合には、シトシンの脱アミノ化で生成したウラシルも本来持っているウラシルも見分けがつきません。一方で、チミンが利用されている場合には、ウラシルが配列に含まれるはずはないので、ウラシルが見つかった時点でシトシンに修正することができます。このように、チミンを利用することで保持している遺伝情報を正確に維持することが可能になります(図5)。
DNA は正確に遺伝情報を維持するためにチミンを利用し、RNA はコストパフォーマンスを高めるためにウラシルを採用しています。DNA は遺伝情報を維持して次世代に伝えることが役割でした。ですので万が一にも間違いがあっては困ります。一方で DNA はそれほど大量に複製される物質ではありません。ですので、高価なチミンを利用することは問題ありませんが、むしろ正確性を保証する方が重要です。一方で、RNA は DNA の情報を写し取って様々な機能を果たすことが役割です。RNA は機能するたびに大量に複製される必要があるため、RNA の合成コストを抑えることはとても重要です。 一方で RNA は役割を終えるとすぐに分解されて、新しい RNA がすぐに合成されていきます。ですので、仮に誤りがあったとしてもいくつか間違ったタンパク質や RNA が合成されるだけで全体としてみると影響は微々たるものと考えられます。したがって、RNA ではコスト重視してウラシルを利用する方が合理的ということになります。
RNA は複雑な構造をとることで様々な機能を実現する
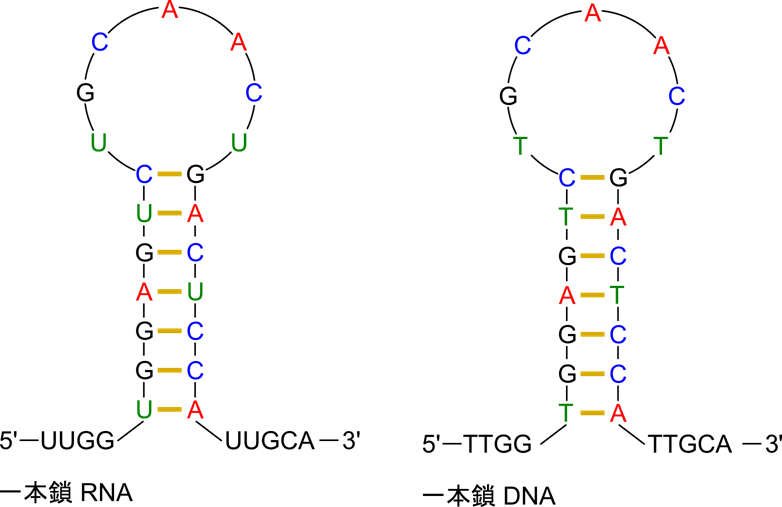
RNA は機能を有する核酸であるため、多様な構造をとることが要求されます。RNA は例えばリボソーム RNA のようにタンパク質合成のために機能したり、tRNA のようにアミノ酸の運搬に関与するなど様々な機能を持っています。このような多様性を発揮するためには配列のバリエーションはもちろんですが、立体構造も様々な構造をとりうることが重要です。一本鎖 RNA のある領域が別な領域と相補的な配列になっており、これらの領域が塩基対を形成することでループを作る場合があります(図6)。このようなループはステムループ(stem loop)と呼ばれており、最も単純な例です。他にも、塩基対を形成している中にところどころ塩基対を形成できない領域が入り込んでいるような構造をとったり、これらの安定化のために Mg2+ などの金属イオンが関与している場合もあります。このように、RNA では単純な一本鎖や DNA のような二重らせん構造とは違い、もっと複雑な立体構造をとることで様々な機能を可能にしています。
今回は核酸の特性を構造面から概観してみました。核酸はタンパク質や糖鎖、脂質などと違って実際の機能は持たず、遺伝子情報を保持するだけというイメージを持たれがちです。そのため、核酸の持つ構造的な特性は重要視されにくいのですが、実際には DNA や RNA の物質的な特性や生体内の機能などは構造に由来するところがとても大きいです。その背景をきちんと理解することで、より深い理解につながりますので、ぜひ勉強してみてください。
文末脚注
1) 水素結合:
水素は電気陰性度(原子が電子を引き付ける力)が弱い元素です。このため電気陰性度が強い元素と共有結合すると電子が相手の原子に引き込まれて水素原子が δ+ 性を持ちます(少し + に傾きます)。この時、水素原子の近傍に π 電子を持つ原子(代表的な原子はフッ素;F、酸素;O、窒素;N)があると互いに静電的な結合を形成します。この弱い結合のことを水素結合といいます。
2) ファンデルワールス力:
原子の内部では常に電子が飛び回っています。このため一瞬一瞬を切り取ってみると電子の局在が偏るため、電荷の偏りが生じる瞬間があります。その結果、分子同士の間に引力が発生することがあります。この力は比較的弱い力のためファンデルワールス力と呼ばれています。
参考文献
Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp694-717
島原健三 (1991). 概説 生物化学. 三共出版. pp. 85-91, pp224-265
Paula Y. Bruice 著、大船泰史、香月勗、西郷和彦、富岡清訳 (2016). ブルース有機化学概説 第3版. 化学同人. pp. 785-796