ミトコンドリアは細胞内でエネルギーを作り出す「工場」として機能します。ここで産生されるATPは、酸化的リン酸化と呼ばれるプロセスを通じて生成されます。この過程は電子伝達系と密接に関連しています。今回は、酸化的リン酸化の概要と電子の運搬を介在する因子について解説します。
ミトコンドリアの構造と機能
ミトコンドリアは、細胞のエネルギーを作り出す中心です。ミトコンドリアの外側には外膜(outer membrane)が存在し、外膜上にはポーリン(porin)と呼ばれるタンパク質が孔を形成して、多くの小分子やイオンを通過させています。内部には内膜(inner membrane)と内膜で囲まれたマトリックス(matrix)が存在します。内膜はほとんどの物質を通すことができないため、特別な輸送体が物質輸送を担っています。また、マトリックスでは脂肪酸酸化や TCA 回路などエネルギー産生にかかわる代謝経路が機能しています。外膜と内膜の間には「膜間腔」が存在しています。内膜上では酸化的リン酸化による ATP 産生が行われています。内膜はひだ状に折りたたまれており、このひだを「クリステ」と呼びます。クリステは、プロトン濃度を局所的に高め、ATPを効率よく生成するために役立っています。
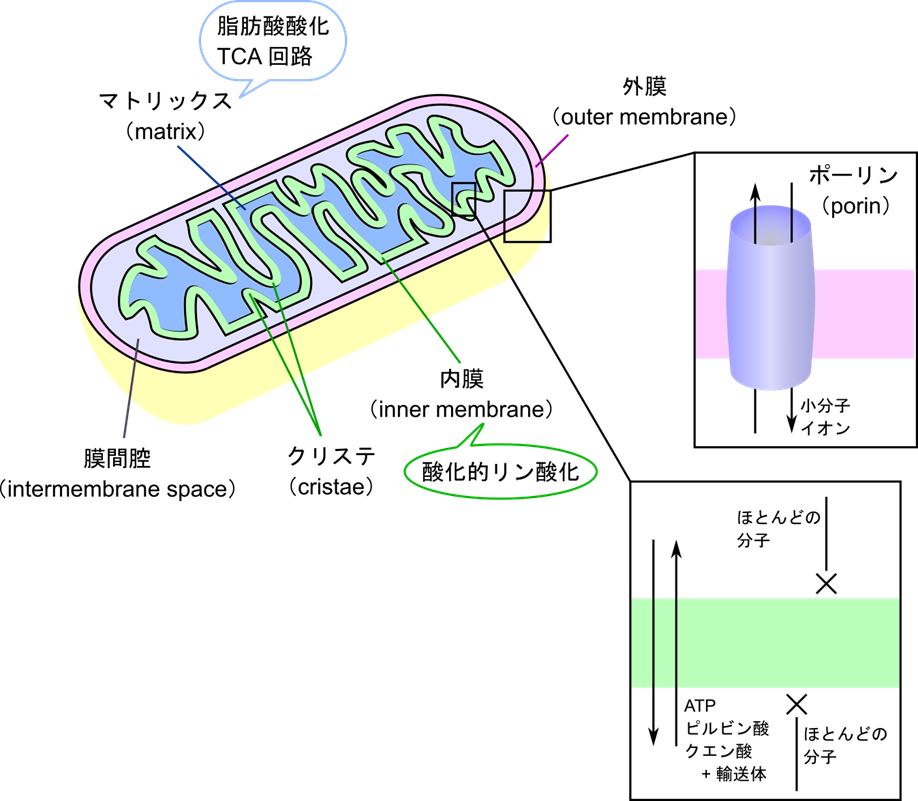
酸化的リン酸化のメカニズム-プロトンポンプと ATP 合成酵素-
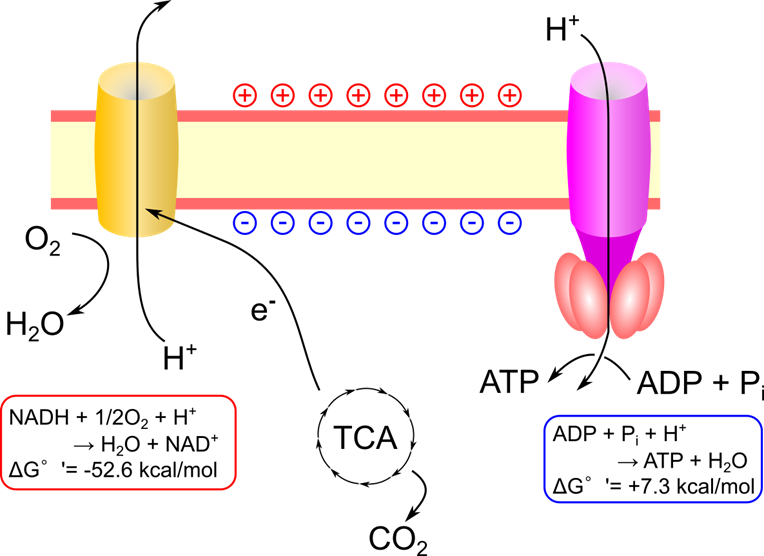
酸化的リン酸化では、マトリックスから膜間腔にプロトン(H⁺)を汲み出す「電子伝達系」と、プロトン勾配を利用してATPを合成する「ATP合成酵素」が機能して ATP が合成されます。
TCA 回路では NAD+ や FAD といった補酵素が還元されて還元型(NADH や FADH2 )になります。これらの補酵素は酸化的リン酸化により酸化されて酸化型(NAD+ や FAD)に変換されます。この時に抜き取った電子により電子伝達系は駆動力を得て、プロトンの汲み出しを行います。電子は最終的に酸素渡されて、水に還元されます。
プロトンが汲み出されると図2のように内膜の膜間腔側にプロトンが集中して膜間腔側は+に、マトリックス側はーに荷電して電位差が生じます。この電位差を膜電位(membrane potential)と呼んでいます。
通常、内膜はイオンを通さないため膜電位は維持されますが、ATP 合成酵素 (ATP synthase)はプロトンを通すことができるため、プロトンは ATP 合成酵素内を通過してマトリックス側に移動します。この時に発生するエネルギーを利用して ATP を合成します。この過程は揚水発電とよく似ています。揚水発電とはポンプで水をくみ上げたのち、水が落ちる勢いを使ってタービンを回して発電する発電方式のことです。水がプロトンに当たります。電子伝達系が本峰としてプロトン(水)をくみ上げて、ATP 合成酵素(タービン)を回してエネルギーを獲得して ATP を合成します。
エネルギーや電子を媒体する分子
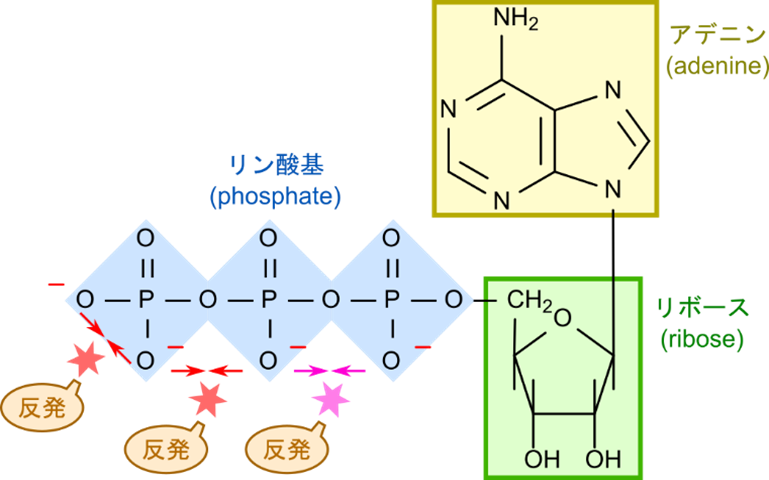
アデノシン三リン酸(adenosine triphosphate; ATP)-生物のエネルギー通貨
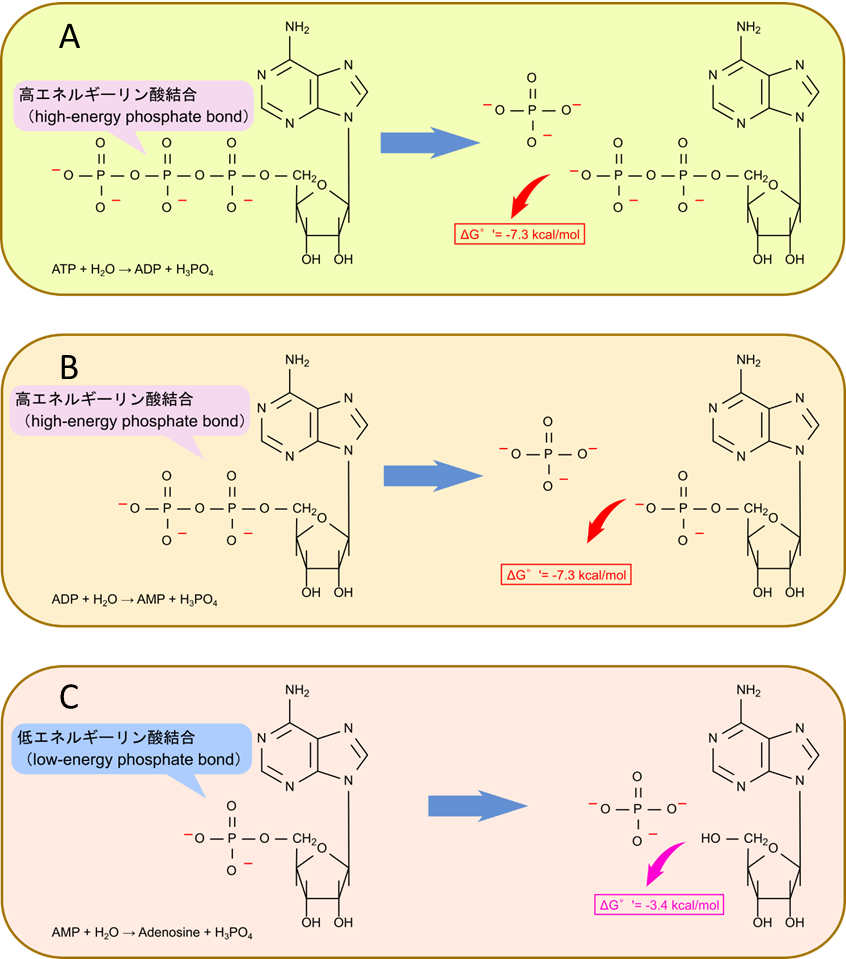
ATP(アデノシン三リン酸)は、生物のエネルギー通貨です。ATPは、アデニン、リボース、リン酸基の3つの要素で構成されています。リン酸基は負に帯電している置換基で、ATP 内では隣接して位置します。このためリン酸基同士の反発が分子内に存在するため、リン酸基間の結合はエネルギーを蓄えています。この結合は「高エネルギーリン酸結合(high-energy phosphate bond)」と呼ばれ、リン酸基が外れる際にエネルギーを放出します(図3)。
図4の A, B に示すように、ATP から ADP への変換や ADP から AMP への変換ではリン酸基同士の分子内反発が解消されるためエネルギーが放出されます。この際のギブスエネルギー変化は -7.3 kcal/mol となります。一方で図4の C で示すように AMP では分子内に静電的な反発がないため、AMP から アデノシン (Ado) への変換のギブスエネルギー変化は -3.4 kcal/mol にすぎません。このような結合は低エネルギーリン酸結合(low-energy phosphate bond)と呼ばれます。解糖系に出てくる、グルコース-6-リン酸やグリセリン-1-リン酸のリン酸も低エネルギーリン酸結合であり、リン酸基を遊離させた場合のギブスエネルギー変化はそれぞれ、-3.3 kcal/mol, -2.2 kcal/mol と、高エネルギーリン酸結合の -7.3 kcal/mol から見るとだいぶ低いです。
電子を運ぶ分子—NAD⁺、FAD、ユビキノン
ATPを合成するために、電子を運ぶ分子も重要です。最も一般的な電子の運び屋はNAD⁺(ニコチンアミドアデニンジヌクレオチド)とFAD(フラビンアデニンジヌクレオチド)です。これらは酸化反応や還元反応に関与し、ATP合成に必要な電子を供給します。さらに、ユビキノン(Q)やシトクロムも電子の運搬に重要です。ユビキノンは2つ、シトクロムは1つの電子を運ぶことができ、これらの分子は電子伝達系において重要な機能を果たしています。
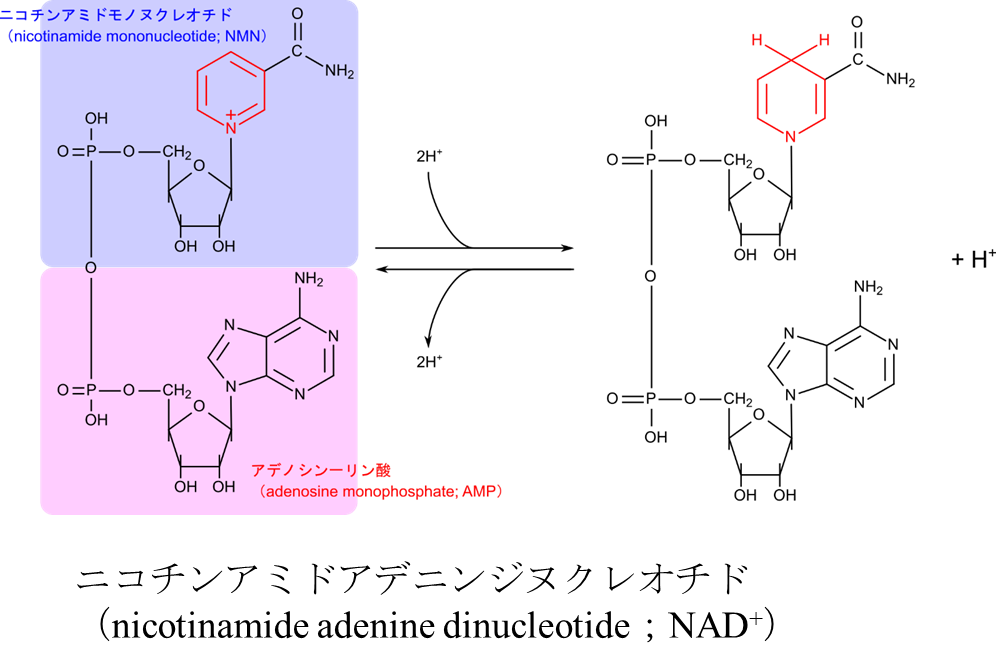
ニコチンアミドアデニンジヌクレオチド(nicotinamide adenine dinucleotide;NAD+)
生体の中では酸化反応や還元反応が数多く行われます。これらの反応では電子が放出されたり、逆に電子が消費されたりします。この電子を運搬するために最もよく使用される電子の運び屋はニコチンアミドアデニンジヌクレオチド(nicotinamide adenine dinucleotide;NAD+)です(図4)。この分子のニコチンアミドが電子を受け取る本体です。NAD+ が電子を受け取る場合についてみてみましょう。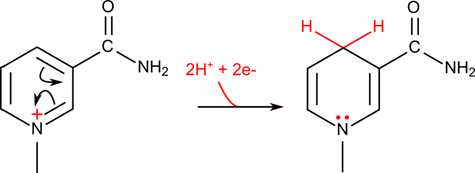
水素が付加されるため、還元型は NADH と表記します。
一方で NADH が酸化される反応では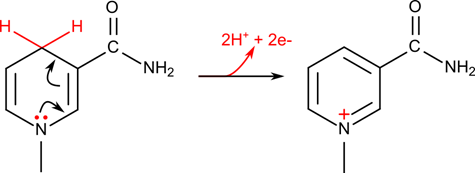
という反応と電子の再配置が起こって NAD+ のような構造になります。このようにニコチンアミドは “電子のコンテナ” のような役割を担っています。
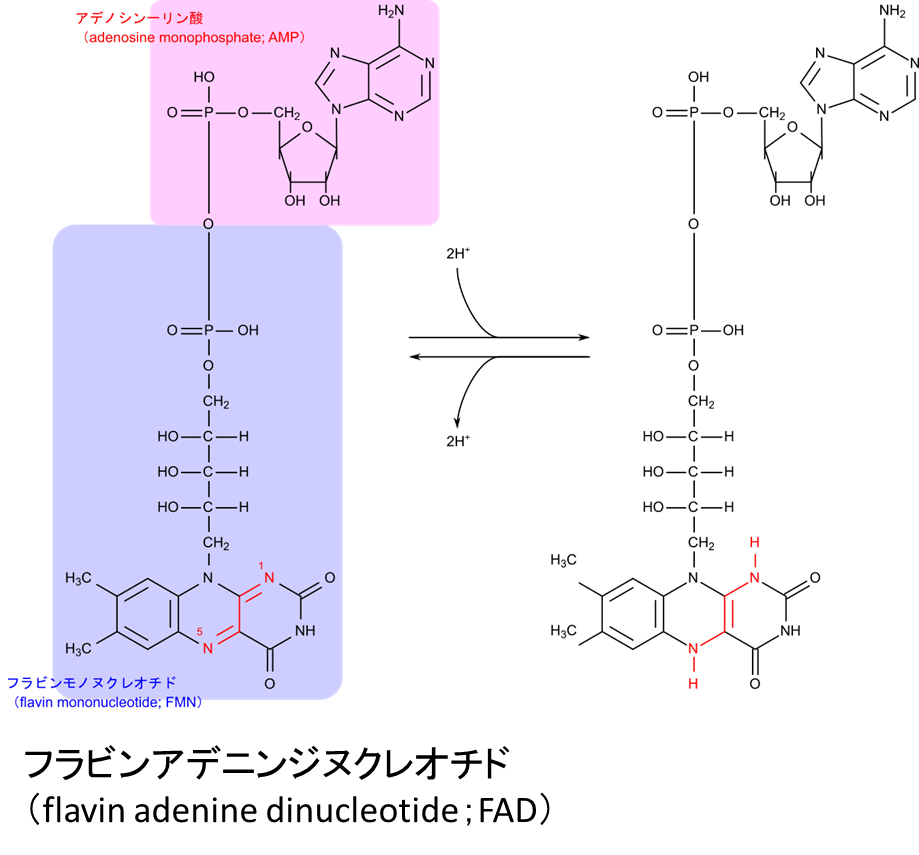
フラビンアデニンジヌクレオチド(flavin adenine dinucleotide)
フラビンアデニンジヌクレオチド(flavin adenine dinucleotide)は TCA 回路などで使用される電子の媒介にかかわる補酵素です(図5)。還元反応は
という反応を経て電子の再配置が起こります。このため、還元型は FADH2 と表記します。
一方で酸化反応では
という反応を介して電子が放出されます。FAD ではリボフラビンが電子を受け取る本体です。なお、FMN であってもリボフラビンを有するため電子を受け取ることが可能です。電子伝達系では FMN が補酵素として機能し電子を受け取る段階があります。
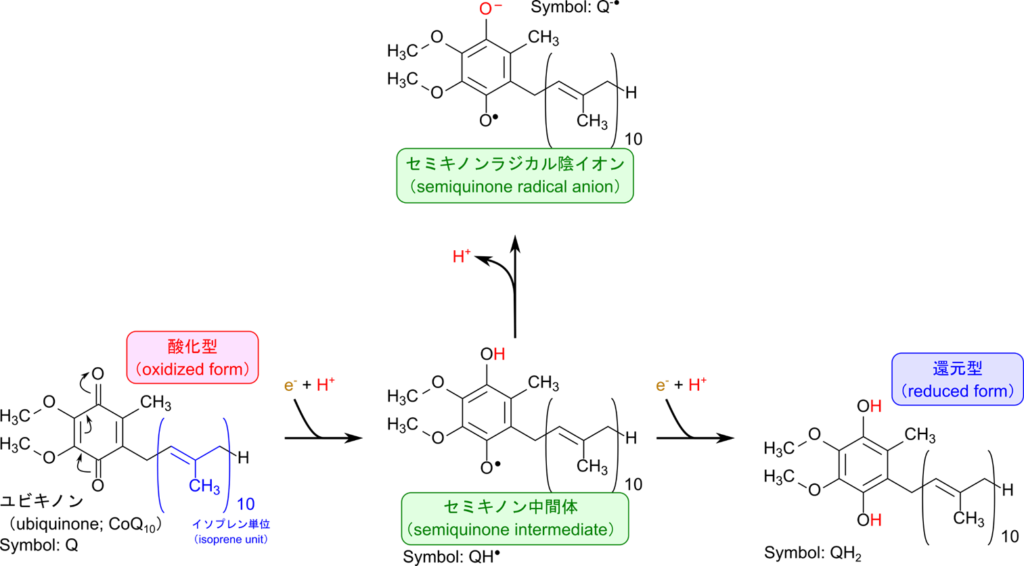
ユビキノン(ubiquinone; Q)
ユビキノン(ubiquinone; Q)は電子伝達系内で電子を運ぶ役割を担ています。ユビキノンはキノンにイソプレンが複数連なった構造が結合した分子です。例えば、哺乳類が多く持つ CoQ10(coenzyme Q10)はキノンにイソプレンが 10 個連なった構造を持っています。
ユビキノンにおける電子を受け取る本体はキノンです。ユビキノンの還元反応はいくつかの段階があります。
酸化型ユビキノン(Q)+ e– →セミキノン中間体(QH・)
セミキノン中間体(QH・)+ H+ →セミキノンラジカル陰イオン(QH-・)
セミキノン中間体(QH・)+ e– →還元型ユビキノン(QH2)
したがって、ユビキノンは電子2つを運搬することができます。なお、還元型ユビキノンはユビキノールともいいます。
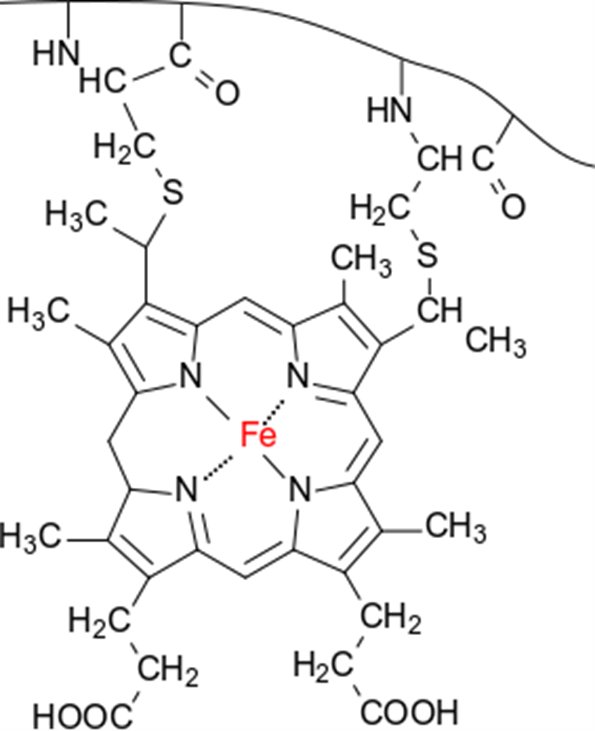
シトクロム(cytochrome)
シトクロムは電子伝達を担うタンパク質です。シトクロムにはシトクロム a1、シトクロム a3、シトクロム b2、シトクロム b5、シトクロム c など様々なものがあります。シトクロムは内部にヘム鉄を持っており、この鉄原子が電子を一つ受け取ると Fe2+(還元型)に、電子を一つ放出すると Fe3+(酸化型)となります(図7)。したがって、シトクロムは電子1つを運搬することができます。
鉄の電子配置と Fe3+(酸化型)や Fe2+(還元型)について
Fe の電子配置を下図に示します。Fe の電子配置では最外電子殻には 4s 軌道の2つの電子だけが入っています。ですのでこの二つの電子が放出されて Fe2+ となります。ところで青の枠に注目していただくと、3d 軌道の一つだけが二つ電子が入っておりちょっとアンバランスですね。そこで 3d 軌道の電子一つが放出されると 3d 軌道のすべての軌道が一つずつ電子が入っている状態(半閉殻状態)となり安定します。この形態は Fe3+(酸化型)として知られています。したがって Fe は Fe2+(還元型)と Fe3+(酸化型)の二種類が存在することになります。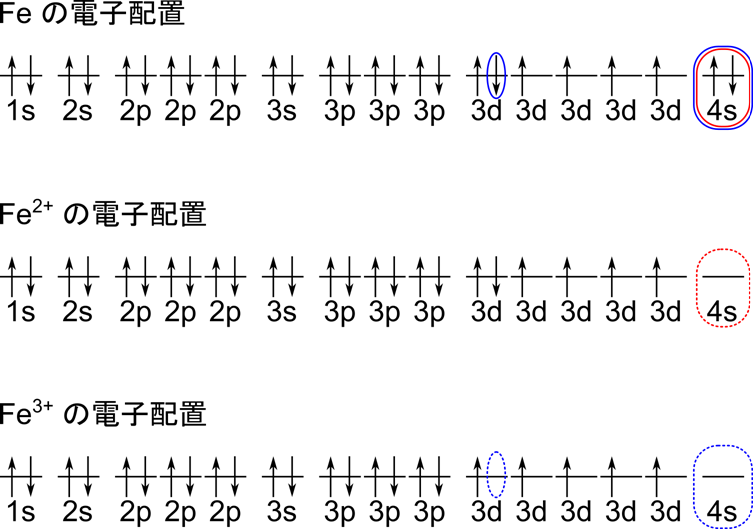
今回は、ミトコンドリア内で行われるATP合成のメカニズムと、電子を運搬する分子について解説しました。ミトコンドリアは、細胞のエネルギー供給の中心であり、酸化的リン酸化を通じて効率的にATPを生成しています。今回は概説にとどめましたが次回からは酸化的リン酸化を担う電子伝達系と ATP 合成酵素についてより詳細を解説していこうと思いますので、そちらもぜひ読んでみてください。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 139-150
- Jeremy M. Berg, John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer著、入村達郎、岡山博人、清水孝雄、中野徹訳 (2018). ストライヤー生化学 第8版. 東京化学同人. pp. 485-519
関連記事
- プロトン勾配と酸化還元反応をエネルギー的な観点から解説:生体内のエネルギー流れ
- 細胞のエネルギー工場:ミトコンドリアとATP生成メカニズム
(←イマココ) - 四つの複合体が連動して機能するプロトンポンプ、電子伝達系
- 化学浸透圧説を徹底解説:プロトン勾配とATP合成の重要なつながり
- NADHの電子はどう運ばれる?ミトコンドリア膜を越えた物質輸送を解説