Contents
アミノ酸の定義と構造について
アミノ酸(amino acid)とはアミノ基(-NH2)とカルボキシル基(-COOH)を持つ物質総称です。カルボキシル基は有機酸を与える置換基ですので、アミノ基+酸=アミノ酸と理解してください。アミノ酸は、様々な生命現象を司るタンパク質の基本単位です。そのため、アミノ酸の性質を理解することは生命現象を読み解くうえで重要です。今回は、アミノ酸の基本構造や分類、性質についてわかりやすく解説します。
アミノ基のつく位置とアミノ酸の分類
アミノ酸はアミノ基の付く位置により分類できます。まず、番号の付け方を見ていきましょう。
- 各置換基の優先順位を確認します
- 優先順位はカルボキシル基の方がアミノ基より高い
→カルボキシル基に近い末端から番号を付ける
- 優先順位はカルボキシル基の方がアミノ基より高い
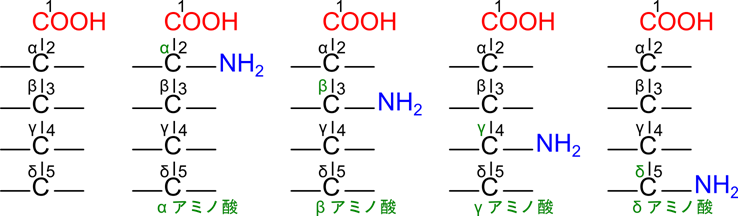
(番号は 1, 2, 3, … と α, β, γ, … の二種類あります。ですので以下はそれぞれについてみていきましょう)
(1, 2, 3, … の番号付けをする場合)
- カルボキシル基の炭素を 1 番として順に 2, 3, 4…と番号を振っていく
- 番号の開始点に注意 !!
- アミノ基がどの位置に着くかを確認します
- (アミノ基の位置)-アミノカルボン酸と命名します。
- カルボキシル基を持つ有機酸(カルボン酸)が基本骨格
- アミノ基が付いているのでアミノカルボン酸
- アミノ基の位置を付けて(アミノ基の位置)-アミノカルボン酸
- 例)
2 位にアミノ基:2-アミノカルボン酸
3 位にアミノ基:3-アミノカルボン酸
(α, β, γ, … の番号付けをする場合)
- カルボキシル基の隣の炭素を α として、β, γ, δ… と番号を振っていく
- 番号の開始点に注意 !!
- アミノ基がどの位置に着くかを確認します
- (アミノ基の位置)-アミノ酸と命名します。
- アミノ+カルボン酸=アミノ酸が基本骨格
- アミノ基の位置を付けて(アミノ基の位置)-アミノ酸
- 例)
α 位にアミノ基: α アミノ酸
β 位にアミノ基: β アミノ酸
二つの命名法では番号の開始点が異なる点に注意です。2位の炭素は α 位、3位の炭素は β 位という具合にズレるので気を付けてくださいね。
アミノ酸の立体異性体
特に α アミノ酸はほとんどの場合が不斉炭素を有します。ですので、アミノ酸には立体異性体が存在します(ただし、グリシンだけは側鎖が水素だけですので例外的に立体異性体がありません)。立体異性体の表記にはいろいろありますが、ここではよく使用される D 体と L 体の表記法についてみていきましょう。
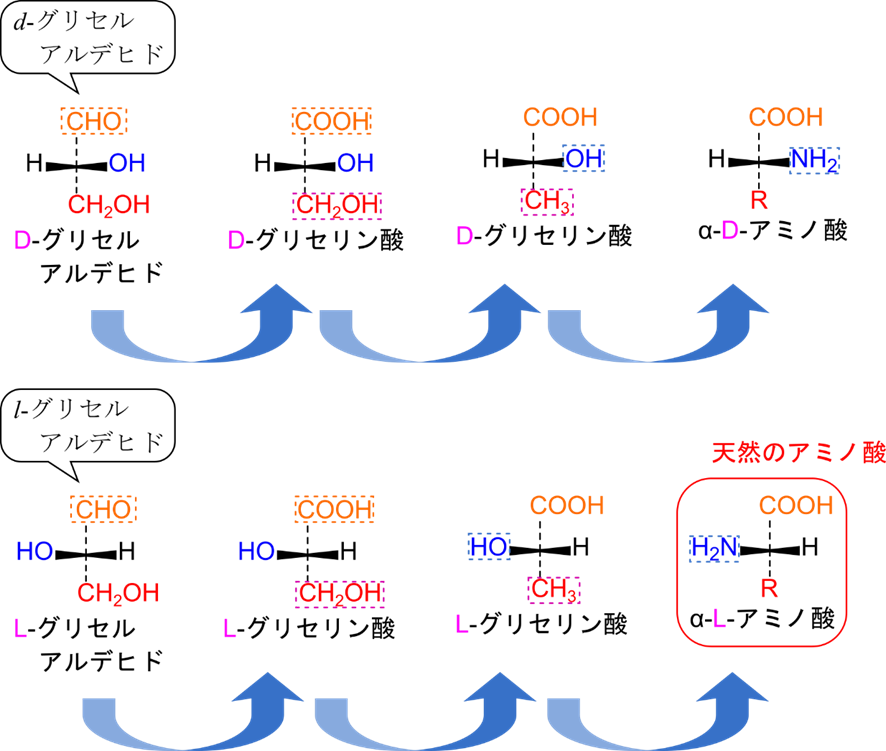
- D 体と L 体はグリセルアルデヒドが基準となります。
- d-グリセルアルデヒド:D-グリセルアルデヒド
l グリセルアルデヒド:L-グリセルアルデヒド
- d-グリセルアルデヒド:D-グリセルアルデヒド
- どちらのグリセルアルデヒドから誘導されるかによって D 体、L 体に分類
- D-グリセルアルデヒドから誘導されるものを D 体とする
L-グリセルアルデヒドから誘導されるものを L 体とする
- D-グリセルアルデヒドから誘導されるものを D 体とする
図2を見てください。d-グリセルアルデヒドのホルミル基をカルボキシル基に変換するとD-グリセリンとなります。次いで、-CH2OH をメチル基に置換すると D-グリセリン酸となります。さらに、ヒドロキシル基をアミノ基に置換すると、D-アミノ酸となります。このように、d-グリセルアルデヒドから誘導して得られるD-アミノ酸といいます。同様に、L-アミノ酸は l-グリセルアルデヒドから誘導されるものを L-アミノ酸と呼びます。通常、生体内では α-L-アミノ酸が見いだされます。
「d 体、l 体」と「D 体、L 体」表記の違いについて
d 体と l 体は旋光性に基づく命名です。詳述はしませんが、アミノ酸には光の振動方向を回転させる能力があります。この時回転させる方向が右回転のものを d 体、左回転のものを l 体といいます。「d 体、l 体」と「D 体、L 体」表記では意味が違いますので、注意してくださいね。
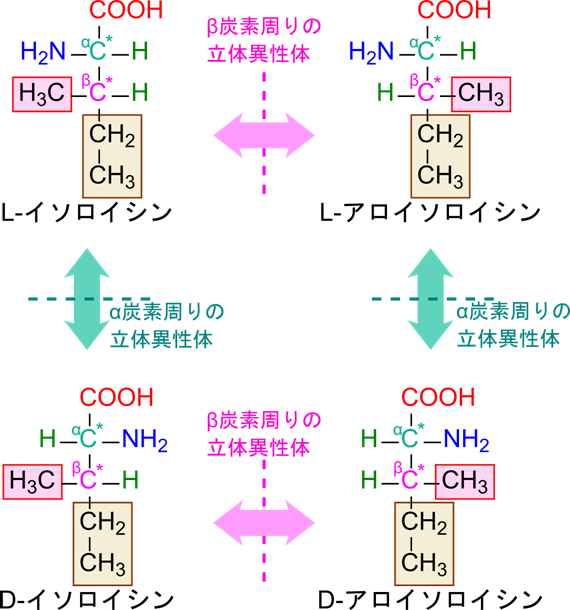
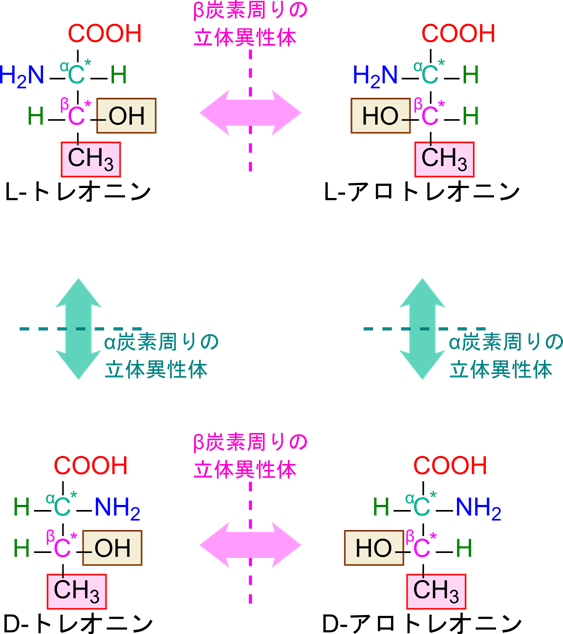
イソロイシンとトレオニンは二つの不斉炭素を持つ
20種類のアミノ酸の内、イソロイシンとトレオニンはα炭素とは別に不斉炭素(β炭素)を持ちます。このため、α炭素で二通りの立体異性体が、β炭素でも二通りの立体異性体が存在します。したがって、全部で2×2=4通りの立体異性体が存在しています。
名前の付け方は以下の通りです。
- α 炭素に起因する立体異性体は D-体 ⇔ L-体で表現します。
- β 炭素に起因する立体異性体はアミノ酸⇔ アロアミノ酸で表現します。
イソロイシンを例に見ていきましょう。L-イソロイシンに対して α 炭素に起因する立体異性体は D-イソロイシンです。一方で β 炭素に起因する立体異性体は L-アロイソロイシンとなります。さらに、D-イソロイシンに対して β 炭素に起因する立体異性体は D-アロイソロイシンといいます(図3-1)。同様に、トレオニンの α 炭素に起因する立体異性体は L-トレオニンと D-トレオニンであり、L-トレオニンに対して β 炭素に起因する立体異性体は L-アロトレオニン、D-トレオニンに対して β 炭素に起因する立体異性体は D-アロトレオニンと命名します(図3-2)。
タンパク質の基本単位、20種類の α-アミノ酸
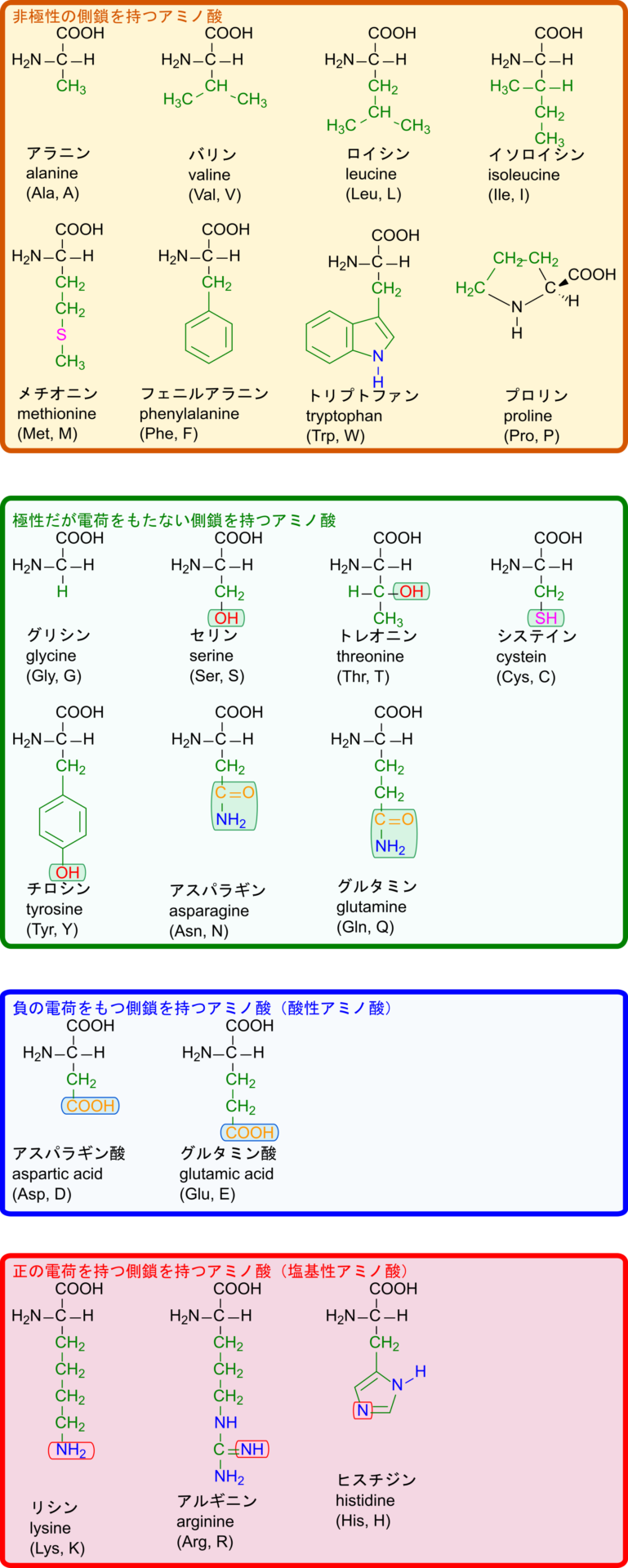
アミノ酸はタンパク質の構成要素となっています。タンパク質は多数のアミノ酸がペプチド結合で重合して高分子化したものです。タンパク質は基本的に 20 種類 α アミノ酸で構成されています。これら 20 種類のアミノ酸にはそれぞれが個性を持っており、この個性がタンパク質の特性の要因となっています。ですので、アミノ酸配列を解析することで、タンパク質の物性や化学特性などを読み解くことができます。このように、アミノ酸の個性を理解することは、タンパク質の特性を理解する上でとても重要になります。以下でアミノ酸の個性と側鎖について確認していきましょう。
化学的特性による分類と構造
アミノ酸の化学的な特性には側鎖に含まれる置換基が大きく寄与しています。この置換基の分類がアミノ酸の性質に大まかなルールを与えます。
- 主に無極性(疎水性)
- 炭化水素鎖
- チオエーテル(メチオニンだけ)
- 正の電荷を持つ(塩基性)
- アミン(-NH2、-NH-、NR3 など窒素を含む)
- 負の電荷を持つ(酸性)
- カルボキシル基(-COOH)
- 極性はあるが電荷はない
- 酸性アミノ酸のアミド(-CONH2 基を有する)
- 水酸基
- チオール基(-SH;システインだけ)
炭化水素だけで構成される側鎖を持つアミノ酸は無極性となります。メチオニンは硫黄があっても両端が炭化水素で構成されており、対称性があるため無極性となります。トリプトファンは例外で、アミンを持つのですが、側鎖全体が大きいため、アミンの影響よりも炭化水素鎖の影響の方が大きいので無極性となります。
水酸基やチオールを持つものはこれらの置換基が極性を与えるので、極性を持つアミノ酸となりますが、電離はしませんので、酸にはなりません(硫黄は酸素と同族元素ですので、酸素と似た挙動をします)。酸のアミドは -CONH2 を持ちますので、カルボニル基の酸素やアミンの窒素が水素結合を形成するため、アミノ酸に極性を与えます。グリシンは例外で、側鎖が水素だけでとても小さく、α アミノ基とα カルボキシル基の影響が大きいので極性をもつ分子となります。ただし、アミノ基(塩基)とカルボキシル基(酸)が互いの電荷を打ち消しあうため、電気的に中性となります。
次に、正の電荷(塩基性)を持つアミノ酸にはアミン(つまり窒素 N )が含まれます。アミンはアンモニアのようにプロトンが配位結合しますので、塩基としてふるまいます。
負の電荷(酸性)を持つアミノ酸にはカルボキシル基(-COOH)が含まれます。カルボキシル基は -COOH が -COO– に電離するので、酸としてふるまいます。
物理的特性による分類と構造
上記とは異なる分類も見てみましょう。この分類では主に構造や含まれる元素によって分類しています。タンパク質ではその形が活性を示す上で重要なファクターとなります。タンパク質が適正な形をとるために、アミノ酸残基の大きさが大きく寄与します。
- 単純アミノ酸:側鎖に芳香環を持たず、単純な炭素鎖のみで構成
- オキシアミノ酸:水酸基を持つ
- 酸性アミノ酸:カルボキシル基を持つ
- 含硫アミノ酸:硫黄を含む
- 酸性アミノ酸のアミド:-CONH2 を含む
- グルタミン酸のアミド→グルタミン
- アスパラギン酸のアミド→アスパラギン
- 塩基性アミノ酸:アミン(窒素)を含む
- 芳香族アミノ酸:芳香環を含む

必須アミノ酸
体内で生合成できないアミノ酸は食事から摂取する必要があります。このようなアミノ酸のことを必須アミノ酸(essential amino acids)といいます。ヒトの場合は以下の通りです。
| アミノ酸 (三文字表記) | 必要量 |
|---|---|
| バリン(Val) | 0.80 g/day |
| ロイシン(Leu) | 1.10 g/day |
| イソロイシン(Ile) | 0.70 g/day |
| メチオニン(Met) | 1.10 g/day |
| フェニルアラニン(Phe) | 1.10 g/day |
| トレオニン(Thr) | 0.50 g/day |
| トリプトファン(Trp) | 0.25 g/day |
| リシン(Lys) | 0.80 g/day |
ちなみに覚え方は「雨降り一色バス」当語呂合わせがあります。アルギニンとヒスチジンが含まれていますが、これらは子供で必須とされているアミノ酸です。

練習問題
問題は自動で更新されます。繰り返し解いて知識の定着に役立ててください!
アミノ酸を分類してください
今回はアミノ酸の基本的な内容についてみていきました。今回紹介したような特性や構造は今後、タンパク質や酵素の機能を見ていくうえで、とても重要な基礎知見となります。これらの特性は側鎖の構造、さらには側鎖に含まれる置換基によっています。ですのでやみくもに丸暗記ではなく、どういった置換基があるのかとアミノ酸特性をリンクさせて覚えてみてくださいね。
参考文献
- 島原健三 (1991). 概説 生物化学. 三共出版. pp. 36-66, 266-271
- John McMurry 著、伊東椒 児玉三明訳 (2018). マクマリー有機化学 第4版. 東京化学同人. pp. 472-501