アミノ酸やペプチドはアミノ基やカルボキシル基など反応性の高い置換基を持っており、これらの置換基を利用した反応や解析手段が考案されています。アミノ酸やペプチドは生体に重要な分子であり、解析することが生命科学ではとても重要な解析手段となっています。今回は、アミノ酸にまつわるいくつかの代表的な反応を解説しようと思います。
Contents
アミノ酸に関する反応と分析方法
アミノ酸塩の生成
アミノ酸は酸や塩基と反応させると塩を形成します。この反応はアミノ基を塩基、カルボキシル基を酸としてとらえて、中和反応のようにイメージするとわかりやすいと思います。例えば、塩酸と反応させる場合では、アミノ基が -NH3+ となっているので Cl– を受け取り、カルボキシル基がプロトンを受け取ります。

一方で、水酸化ナトリウムと反応させる場合では、カルボキシル基が -COO- となっているので Na+ を受け取り、アミノ基からプロトンが供与されて H2O が生成されます。
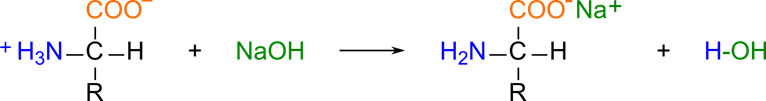
エステル化と酸アミド形成
カルボキシル基の炭素は(酸素が結合しているため)δ+ 性を有しています。アミノ酸にアルコールを作用させると、水酸基の酸素が非共有電子対を持っているため、カルボキシル基の炭素を求核的に攻撃して結合を形成し、カルボキシル基の OH 基がプロトンを受け取って H2O として脱離します。すると、アミノ酸エステルが形成されます([2] の構造:エステル化)。
アミノ酸エステルのエステル結合の炭素はやはり δ+ 性を有しています。このため、アルコール中でアンモニアを作用させると、アンモニアの(非共有電子対を有している)窒素が炭素を求核的に攻撃して結合を形成し、アルコール部分がプロトンを受け取って脱離し、酸アミド([3] の構造)が形成されます。
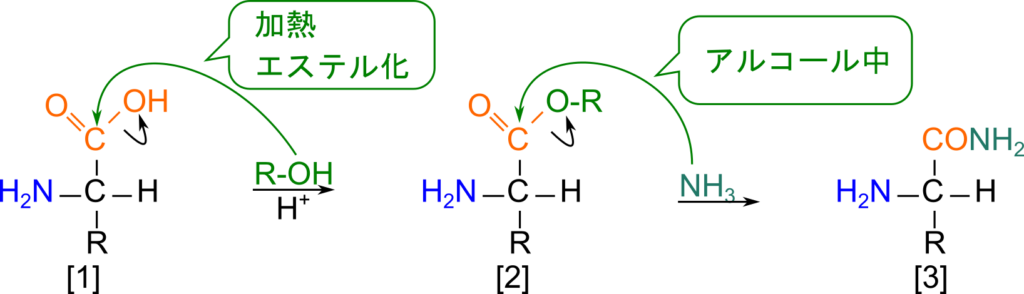
酸クロリドや(無水酢酸のような)酸無水物と反応させると、カルボニル基(C=O)をアミノ基が求核的に攻撃して結合を形成し、N-アシルアミノ酸を生成します。
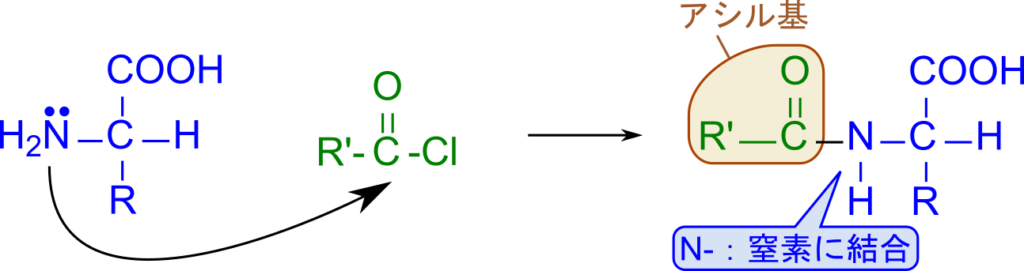
アミノ酸の分析手法
Van slyke 法によるアミノ酸定量
アミノ酸溶液中のアミノ酸量を定量するにはどうしたらいいのでしょうか?Van slyke 法はこのような疑問を解決する方法です。アミノ酸に酢酸溶液を添加し亜硝酸(HNO2)を作用させると図5のようにアミノ酸1分子に対して、1分子の窒素ガスが発生します。このため発生した窒素ガス量を(ガスビュレットなどを用いて)測定することでアミノ酸量を定量することができます。ここで、窒素ガスの窒素原子一つは亜硝酸に由来しており、もう一つはアミノ酸のアミノ基に由来します(図5で色分けしています)。ですので、アミノ酸1分子に対して窒素が1分子発生しますので注意してください。
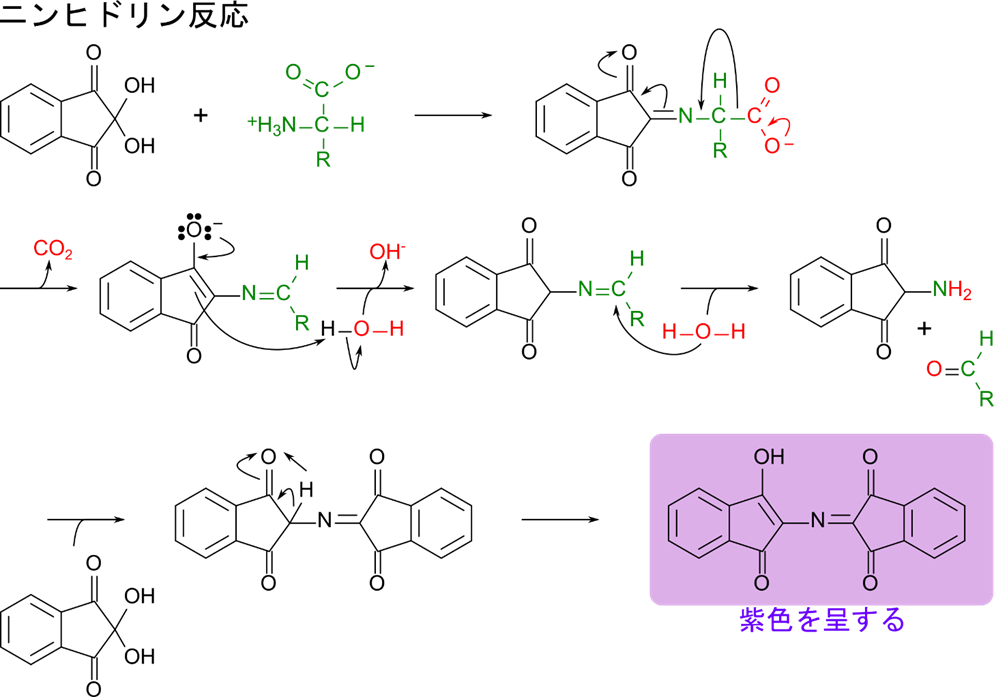
ニンヒドリン反応によるアミノ酸の検出
アミノ酸とニンヒドリンを加熱すると、図6に示したような反応を介して紫色に発色します。この反応は鋭敏にアミノ酸を検出することができるため、アミノ酸の検出や定量に利用されます。この反応ではニンヒドリンがアミノ酸と反応することで、反応が進行して最終的にもう一分子のニンヒドリンとカップリングして紫色の色素が産生されます。したがって、アミノ酸1分子から色素1分子が生成されるので定量に利用することも可能です。なお、この色素は λ=570 nm の波長に吸収極大を持っているので、570 nm の吸光度を測定することで定量が可能です。
ペプチド・タンパク質の解析にかかわる分析手法
Edman 分解
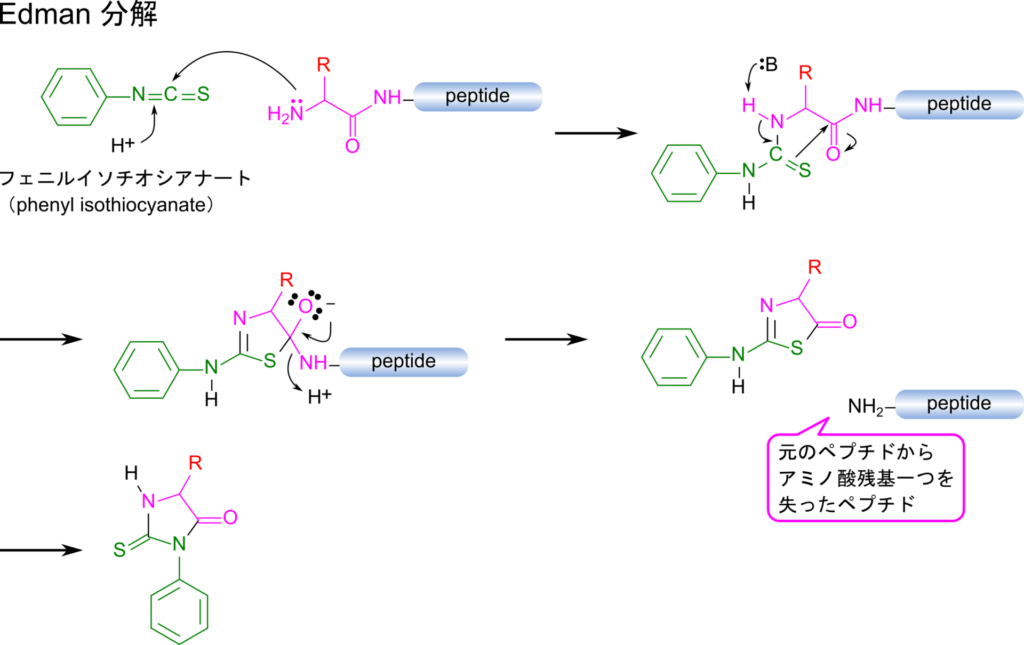
Edman 分解はペプチドの N 末端側から一つずつアミノ酸残基を切断していく反応です。タンパク質のアミノ酸配列を知ることはタンパク質の機能解析や同定の第一歩です。そこで Edman 分解を利用して N 末端側から一つずつアミノ酸を遊離させては解析していくことでアミノ酸の配列を直接解析することができます。Edman 分解ではあまり多くのアミノ酸配列を解析することはできませんが、プロテアーゼを使って消化し、それぞれの断片について解析することでこういった問題を解消することも可能です。
アミノ酸配列を知る方法はいくつかありますが、Edman 分解を利用した方法は実際に機能しているタンパク質の配列を直接知ることができるという点で大きなアドバンテージがあります。アミノ酸配列を知る方法として最もよく使われるのは塩基配列から推定する方法です。ですが、この方法で知ることができる配列はあくまでも”推定”です。実は一部のタンパク質では翻訳後に配列が変わってしまうことがあります。こういった変化は直接アミノ酸配列を解析しないと知ることができません。他にも、タンパク質は翻訳後、様々な点で分解を受けながら活性が変化していきます。この切断される点も実際のアミノ酸配列を解析しないと理解することができません。このように、タンパク質のアミノ酸配列を直接解析することは様々な情報を得ることができるとても重要な解析手段です。
Edman 分解はフェニルイソチオシアネートと反応させることで N 末端のアミノ酸が標識されます。その後、(トリフルオロ酢酸蒸気などを作用させて)切断することでフェニルチオヒダントイン (PHT)-アミノ酸誘導体が遊離します。この結果残ったペプチドは N 末端のアミノ酸残基一つ分短くなったペプチドになります。遊離した PHT- アミノ酸は特定の波長の光を吸収するようになるので、高速液体クロマトグラフィー(HPLC)などを用いて分離して分光光度計を使って検出することでどのアミノ酸かを同定することができます。この操作を繰り返すことで、N 末端側からアミノ酸を遊離させていきながら解析していくことが可能です。
質量分析(mass spectrometry)
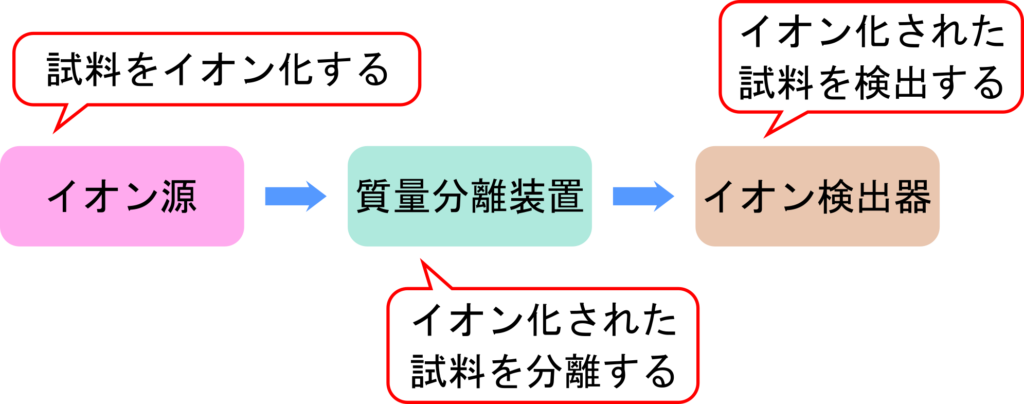
質量分析とは文字通り分析対象となる成分を質量/電荷比(m/z 比)によって分離・検出する方法です。質量分析装置は試料をイオン化するイオン源、試料を分離する質量分離装置、試料を検出するイオン検出器で構成されています。イオン化の方法には MALDI(matrix-assisted laser desorption/ionization)法や ESI(electrospray ionization)法などいくつかの方法が知られています。MALDI 法や ESI 法はタンパク質のような高分子で揮発しにくい分子でもイオン化が可能な方法として開発されました。イオン化された試料は質量/電荷比に応じて分離されます。この方法には TOF-MS(Time of flight mass spectrometry)法が知られています。こうして分離された試料はイオン検出器で検出されます。
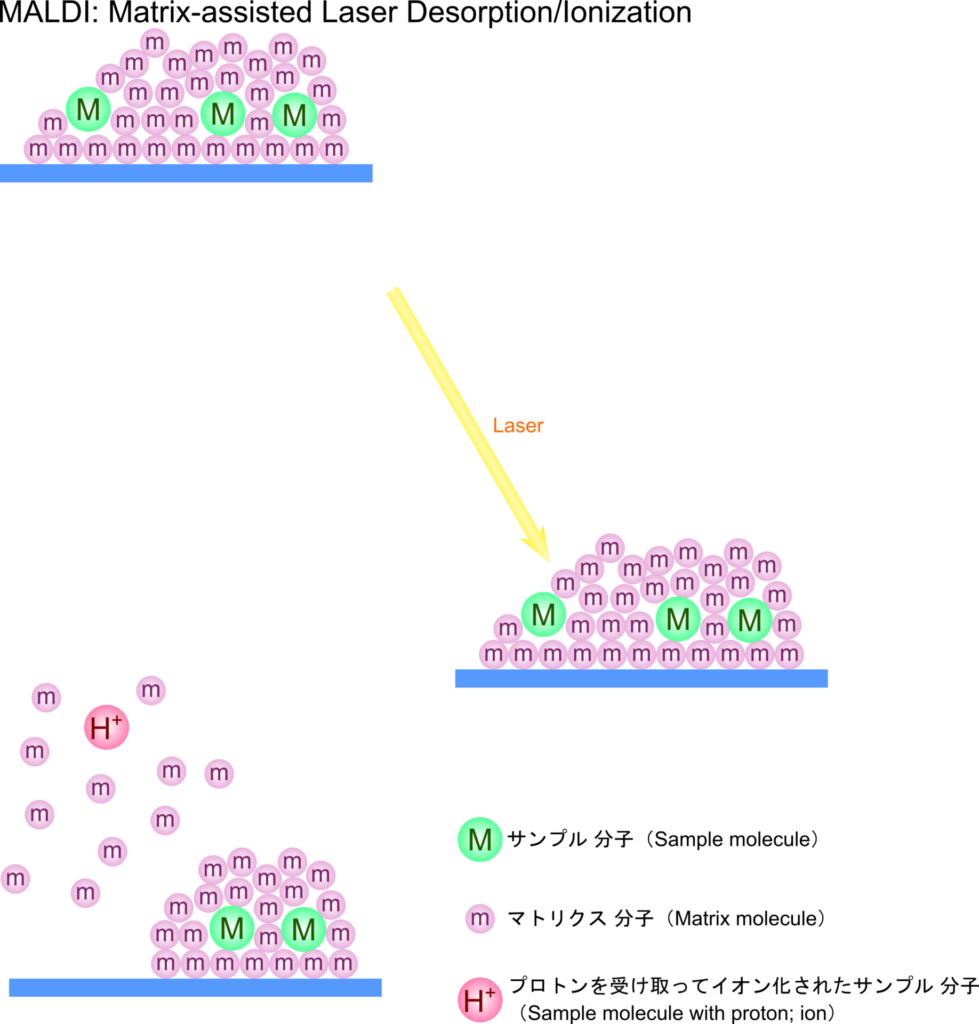
MALDI 法によるイオン化
MALDI 法は芳香族化合物のような分子(マトリクス)と一緒に分析種* をイオン化させることにより、イオン化と気化を起こしやすくした方法です。まずマトリクス中に対象となる分析種を分散させ、装置内の真空部分に導入します。そこにマトリクスが吸収する波長のレーザー光を照射すると、マトリクスはレーザー光を吸収して発熱することにより脱離します。さらに、レーザー光により電子が励起されてマトリクスがイオン化されます。この時分析種も同時に脱離しますが、その後イオン化したマトリクスからプロトンを受け取って分析種がイオン化されます。
この方法では大多数のマトリクス中に分析種を置くことにより、普通は気化しないような分析種でもマトリクスの助けを得ることにより気化させることが可能となります。
* 分析種(Analyte):分析試料又は試料溶液中の被検査成分”のこと
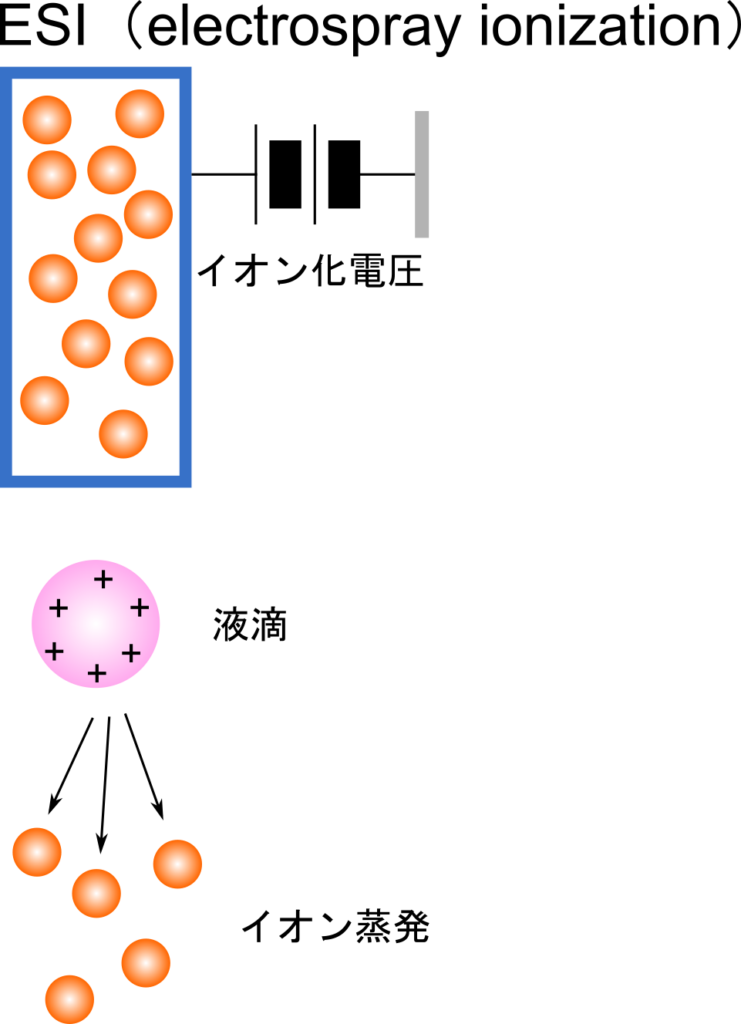
ESI 法によるイオン化
ESI 法では高電圧をかけている細管の中を試料溶液が通ることにより電荷を帯びます。この試料溶液は細管を通り抜けると低圧化のイオン化室に入り、噴霧されます。噴霧される段階では分析種が荷電しているので互いに斥力が働いています。噴霧された液滴から溶媒が蒸発して失われていくと、液滴が持つ電荷密度が高くなるため液滴が分裂していき、最終的に分析種がイオン化します。
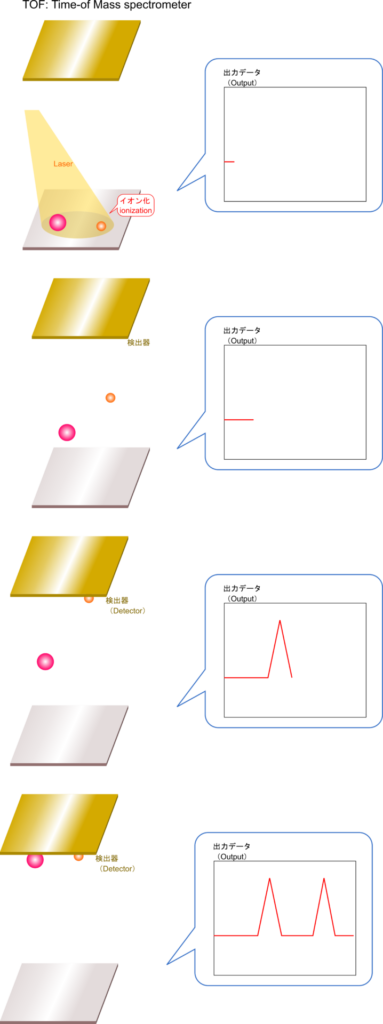
TOF-MS による分析種の分離
TOF-MS ではイオン化された分析種を電場の中に置くことで分離されます。イオン化された分析種は荷電しているため、電場中に置くとクーロン力(静電気力)を受けて移動します。この時に分析種が受けるクーロン力は分析種が持つ電荷と電位差によって決まります。分析種が持つ電荷が同じ場合には受ける力が同じなわけですから、質量が大きいほうが動きにくく、質量が小さいほうが速く動くことになります。この性質を利用して質量の違いによって分離することができるというわけです。質量分析で得られた結果は質量スペクトル(MS spectrum; 複数形は MS spectra)と呼ばれます。
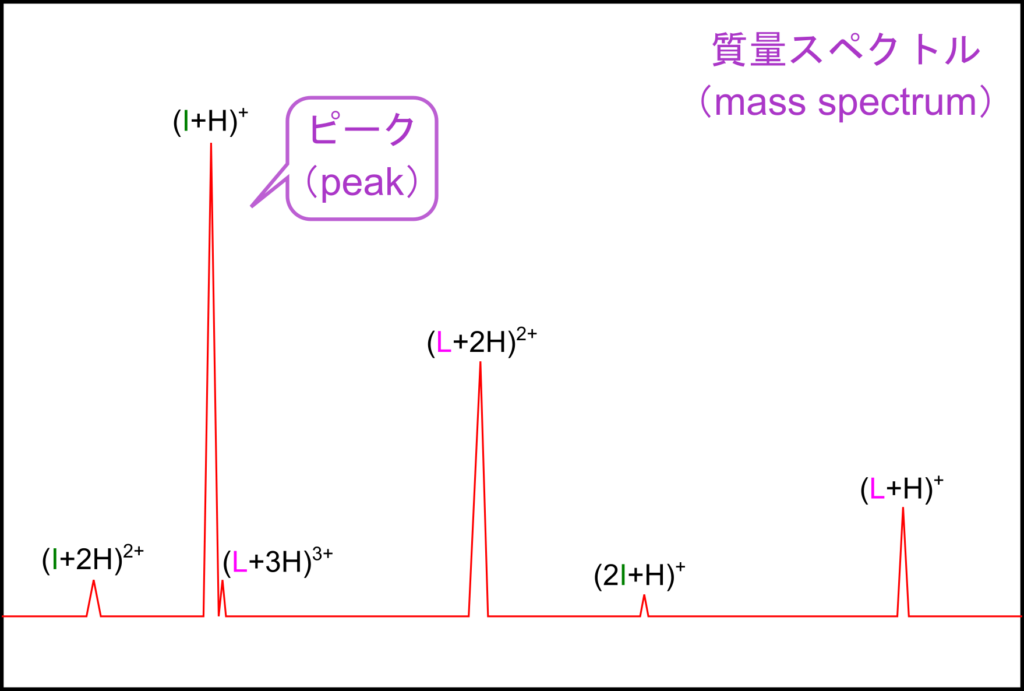
あるタンパク質 “I” と “L” の質量スペクトルを模式的示しています。 I からは (I+H)、(I+2H)、(2I+H) の三種類の分析種が得られています。一方で L 空は (L+H)、(L+2H)、(L+3H) の三種類が得られます。なお、Hは受け取ったプロトンを表しています。したがって、それぞれの分析種によって持っている電荷が異なってきます。
分析種のイオン化の結果によっては二価になるなど、同じ質量でも電荷が異なる分析種が発生する場合があります。このような場合は分析種が受けるクーロン力に差が生まれてくるのでピークが出現するパターンが異なってきます。こう聞くと、結果が混乱しそうですが、実際には二価や三価の時の電荷は予測がつきますので、これらの電荷の異なりも同定の情報として利用が可能です。このため、電荷の異なりは同定の精度を上げるために利用できる情報となります。
このようにして、ある試料中に含まれるタンパク質やペプチドを分析することが可能になります。
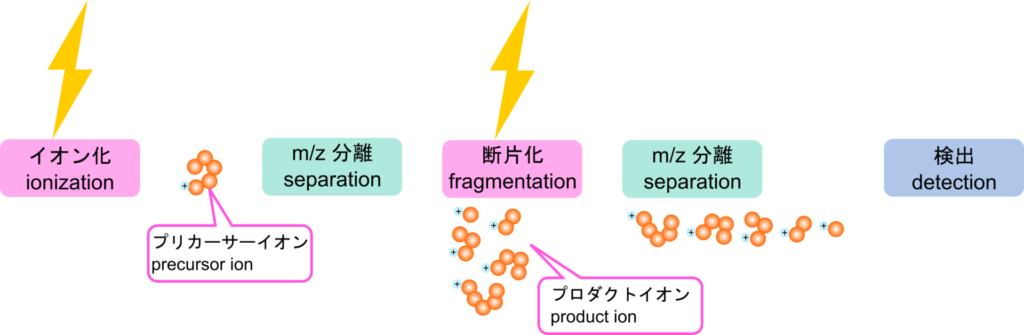
タンデム質量分析によるアミノ酸配列の決定
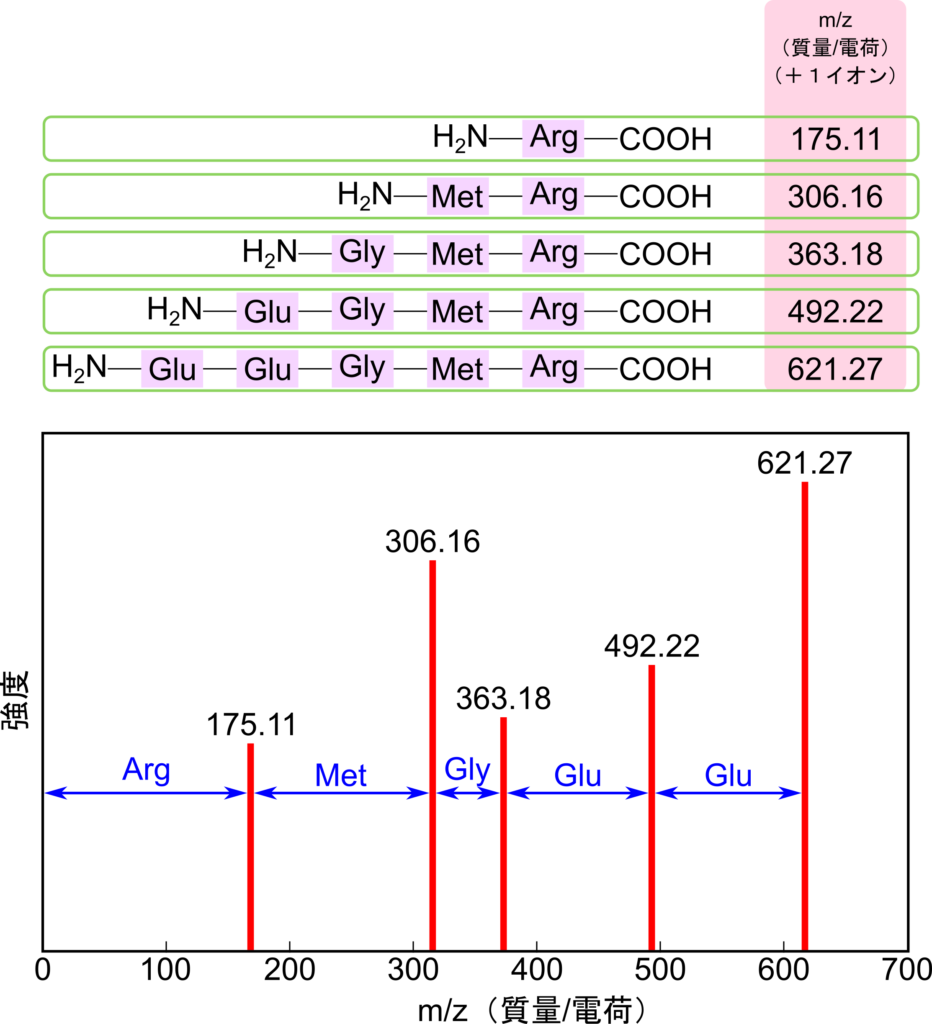
質量分析では含まれているタンパク質を分析することが可能でした。この質量分析を二台直結させるとさらに詳細な分析が可能になります。まず最初の質量分析装置でタンパク質を分離することができますね。これは全項目で議論した内容の通りです。この時に精製されたイオン化した分析種をプリカーサーイオン(precursor ion)といいます。その後、イオン化した分析種を再び二つ目の質量分析装置で不活性ガスと衝突させることにより様々な長さの断片に断片化します。この断片(プロダクトイオン;product ion)はいずれもカルボキシル基末端がイオン化されています。これらの断片を質量分離装置を使って分離することで様々な長さの断片を検出することができます。図12を見てください。あるペプチドをタンデム質量分析にかけた例を示しています。プロダクトイオンはアミノ酸が一つずつ異なる長さに断片化されています。この断片を分離すると、それぞれの断片が検出されます。検出されるそれぞれのピークは各断片に対応しているわけですので、ピーク同士の間隔はそれぞれ対応するアミノ酸に対応する情報を持っていることになります。つまり一つ目のピークは最も短い断片を反映しているわけですので、このピークが検出されるまでは一つ目の Arg 残基を反映しています。二つ目のピークは二番目に長い断片を反映しています。したがって一つ目と二つ目のピークの差は二つ目のアミノ酸(Met 残基)を反映していることになります。このようにして m/z 比から対応するアミノ酸を割り出すことでアミノ酸配列を決定することができます。
今回はアミノ酸やペプチド、タンパク質に関連する反応や解析方法をまとめてみました。これらの反応は現在でも様々な解析方法に応用されています。特にタンパク質の解析手法として紹介した Edman 分解や質量分析はタンパク質の解析では必要不可欠な解析手法です。少し、物理っぽい内容も含むので戸惑うかもしれませんが、イメージしやすくまとめましたのでぜひよく勉強して理解してみてください。
参考文献
- •島原健三 (1991). 概説 生物化学. 三共出版. pp. 36-66, 266-271
- •John McMurry 著、伊東椒 児玉三明訳 (2018). マクマリー有機化学 第4版. 東京化学同人. pp. 472-501
- •Paula Y. Bruice 著、大船泰史、香月勗、西郷和彦、富岡清訳 (2016). ブルース 有機化学 概説 第3版. 化学同人. pp. 647-651
- •寿治工藤, & 崇韮澤. (2011). 解 説 質量分析:MALDI-TOF-MS による材料評価 Mass Spectrometry : Evaluation of Industrial Materials Using MALDI-TOF-MS. 日本画像学会誌, 50 巻(5), 448–454. https://doi.org/10.11370/isj.50.448
- •中西 豊文. (2008). 質量分析法の原理と応用. 臨床化学, 37(3), 317–326.